§ 33. Ступінь окиснення
У цьому параграфі ви дізнаєтеся:
• що називають окисненістю атомів у сполуках;
• що таке позитивна і негативна окисненість атомів елементів у сполуках;
• що називають ступенем окиснення атома в сполуці;
• як визначають ступінь окиснення атомів елементів у сполуках;
• як складають формули сполук за відомими ступенями окиснення елементів.
Коли елемент утворює просту речовину, наприклад метал або гази (водень H2, кисень O2, азот N9 тощо), то електрони, що беруть участь в утворенні ковалентного неполярного зв’язку, однаковою мірою належать обом атомам.
Інакше розподіляються електрони між атомами в складних речовинах, тобто речовинах, утворених атомами різних елементів. У таких сполуках, що утворені ковалентним полярним зв’язком, має місце несиметричний розподіл зв’язувальних електронів відносно атомів різних елементів. У сполуках з йон-ним зв’язком зв’язувальні електрони, які ще називають валентними, практично повністю переходять від атома одного елемента до атома другого.
Така нерівномірність розподілу електронів між атомами в сполуках одержала назву окисненості. Для її кількісної характеристики використовують поняття ступінь окиснення.
Ступінь окиснення— це умовний заряд атома в речовині, який виник би на атомі за умови, що спільні електронні пари повністю змістилися б до більш електронегативного (до більш немета-лічного) атома (внаслідок чого атоми перетворилися б на йони).
Зверніть увагу: позначення ступеня окиснення відрізняється від позначення заряду йона. Ступінь окиснення позначають так: спочатку вказують знак заряду («+» або «-»), потім число
-2 *2 -З
(наприклад. О, Ca, Cr). Заряд йонів записують навпаки: спочатку число (крім 1, яку не вказують), а потім знак — Cl , K , Mg2' , S2 .
Визначаючи ступінь окиснення, не беруть до уваги міру зміщення електронів від атома одного елемента до атома другого елемента. Наприклад, у сполуці з ковалентним полярним
*і -і
зв’язком HCl (де електрони лише частково зміщуються до ато-
*і -і
ма Хлору) і в сполуці з йоиним зв’язком KCl (тут електрони практично повністю зміщуються до атома Хлору) — атому Хло-
ру приписують однаковий ступінь окиснення -1, а атомам Гідрогену й Калію +1.
Ступінь окиснення позначають арабською цифрою (зі знаком «+» або «-» перед нею), яку ставлять над символом елемента,
+5 -2
наприклад P2Or,.
Правила визначення ступеня окиснення елемента за хімічною формулою сполуки. Для визначення ступеня окиснення атома в сполуці необхідно взяти до уваги таке.
1. Вважають, що ступінь окиснення атомів у молекулах простих речовин (N2, Br2, H2, O2, N2, Cl2 та ін.), а також атомів металічних елементів (Li, Na, К, Be, Mg, Ca, Al, Zn, Ag, Cu тощо) і не-металічних елементів (В, С, S, Si та ін.) у вільному стані дорівнює нулю, тому що зміщення спільних електронних пар не відбувається, тобто електрони в них розподілені рівномірно між атомами.
2. У всіх сполуках атоми лужних металічних елементів мають ступінь окиснення +1, а лужноземельних — +2; атоми металічних елементів побічних підгруп часто мають декілька значень ступеня окиснення.
3. Гідроген у сполуках із иеметалічними елементами має
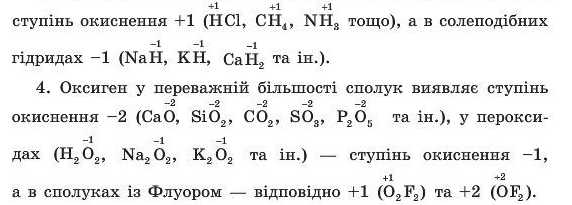
5. Флуор — найбільш електронегативний хімічний елемент, тому ступінь окислення його в усіх речовинах, крім F2, дорівнює -1.
6. Алгебраїчна сума ступенів окиснення атомів усіх елементів, що входять до складу будь-якої речовини, дорівнює нулю, через те що найменша частинка речовини — чи то простої (наприклад, O2), чи то складної (наприклад, Na3PO1) — електро-иейтральиа, а отже, сума позитивних ступенів окиснення має дорівнювати сумі негативних. У бінарних сполуках ступінь окиснення елементів з більшою електропегативністю негативний, а з меншою — позитивний.
Поняття «ступінь окиснення» та «валентність» не треба ототожнювати. Валентність елемента визначається числом
спільних електронних пар, які сполучають атом даного елемента з іншими атомами. Так, у молекулі гідроген ціаніду HCN (синильної кислоти)
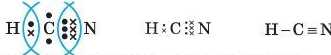
атом Гідрогену одновалентний, атом Нітрогену — тривалентний, атом Карбону — чотиривалентний.
Значення валентності не буває від’ємним чи нульовим. Ступінь окиснення, навпаки, може набувати як позитивних і негативних значень, так і дорівнювати нулю. Наприклад, атоми Нітрогену в молекулі N обидва тривалентні


Нітрогену виявляє однакову валентність III, але різний ступінь окислення: -3 і +3.
Поняття «валентність» застосовують для сполук з ковалентним зв’язком (полярним та неполярним), а ступінь окислення — як для сполук з ковалентним, так і йонпим зв’язком.
Визначення ступеня окиспення елемента за хімічною формулою сполуки. За відомим ступенем окиспення одних елементів у сполуці можна визначити ступінь окиснения інших, не вдаючись до міркувань про зміщення електронів.
Приклади розв’язування задач
Приклад 1. Визначте ступінь окиспення (CO) атома Фосфору в ортофосфатній кислоті H3PO1.

Складання формули сполуки за відомими ступенями окис-ненпя елементів. Скласти формулу бінарної сполуки можна у такий спосіб.
Приклад 2. Складіть формулу сполуки Кальцію з Нітрогеном, якщо ступінь окиснення атома Кальцію +2, а атома Нітрогену -3.

Розв’язання
За встановленими правилами символ найбільш електронегативного елемента записують у формулі сполуки на останньому місці. Отже, символ Ca — елемента з позитивним ступенем окиснення — записуємо на першому місці й указуємо для кожного
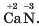
з елементів їхні ступені окиснення:
Далі знаходимо найменше спільне кратне стуленії окиснення, не враховуючи їхні знаки:
2-3 = 6.
Потім ділимо найменше спільне кратне на абсолютні значення ступенів окиснення елементів, тобто Н£ 2 і на 3, та одержуємо індекси: для атома Кальцік — 6 : 2 = 3, а для атома Нітрогену — 6:3 = 2. Після цього вводимо індекси у формулу сполуки:
Ca3N2. ‘
Визначаємо сумарне значення ступенів окиснення атомів у сполуці. Оскільки воно дорівнює нулю:
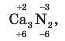
формулу складено правильно.
Для кожного елемента характерний вищий та нижчий, а для деяких елементів і проміжний ступінь окиснення атома в сполуці.
Для металічних елементів нижчий ступінь окиснення дорівнює нулю, а вищий — номеру групи зі знаком «+». Для більшості неметалічних елементів нижчий ступінь окиснення дорівнює різниці між номером групи, у якій розташований елемент, і числом 8. Усі інші значення ступеня окиснення будуть проміжними. Наприклад, для атома Натрію нижчим ступенем окислення в сполуці буде 0, а вищим +1. Для атома Сульфуру нижчим ступенем окиснення буде 6 - 8 = -2 (6 — це номер групи), а вищим — +6. Інші ступені окиснення, характерні для атома Сульфуру, такі: 0, +2, +4.
Якщо потрібно скласти формулу бінарної сполуки, наприклад:
• Фосфору з Гідрогеном, де P має валентність III;
• Сульфуру з Хлором, де S має валентність II;
• Оксигену з Флуором, де О має валентність II;
• Фосфору із Сульфуром, де P має валентність III, a S — II, з подальшим визначенням їхніх ступенів окиснеипя зі знаком «+» або «-», треба користуватися таблицею електроиегативності елементів (табл. 14 в § 28).
Приклад 3. Складіть формули сполук: арсен(ІН) гідриду, сульфур(ІІ) хлориду, оксигеп(ІІ) фториду, фосфор(ІІІ) сульфіду.

Розв’язання
Формула сполуки Арсену з Гідрогеном з урахуванням їхніх валентностей така: АзН;<. Однак, беручи до уваги, що EH (As) більша за EH (Н), на останньому місці запишемо символ найбільш електронегативного елемента:
і візьмемо його зі знаком «-».
Міркуючи подібним чином відносно інших сполук, будемо мати:
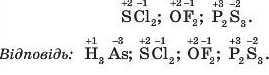
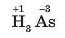
Запитання та завдання
0I. Дайте визначення ступеня окиснення.
,!2. Яким не може бути ступінь окиснення якогось елемента в сполуці?
а) +2; б) +5; в) +10.
3. Укажіть, у якій зі сполук атом Карбону виявляє нижчий, вищий або проміжний ступінь окиснення: a) CO; б) CH1; в) CF1; г) CO2; ґ) C2H2.
°А. У яких сполуках ступінь окиснення атома Хлору дорівнює +3?
a) ClF3; б) ClO2; в) Cl3N; г) PCl3; ґ) FeCl3.
*5. Укажіть, у якій із наведених сполук ступінь окиснення Силіцію дорівнює -4:
a) SiF1; б) SiS2; в) Ca2Si; г) SiH1.
6. Складіть хімічні формули таких сполук:
а) Кальцію з Гідрогеном; б) Натрію з Нітрогеном; в) Сульфуру з Флуором; г) Фосфору з Калієм.
*7. Наведіть по дві формули речовин, у яких ступінь окис-нення Нітрогену й Оксигеиу відрізняється від їхніх валентностей.
8. Визначте ступінь окиснення Сульфуру в таких сполуках: H2S, SF6, S8.
9. Чи змінюється ступінь окиснення Сульфуру в разі переходу від H2SO1 до:
a) Na2SO3; б) S8; в) H2S?
І Тестові завдання
1. Яку з наведених нижче характеристик атомів використовують для визначення типу хімічного зв’язку між ними?
а) число електронів на зовнішньому енергетичному рівні;
б) радіус;
в) електропегативність;
г) валентність.
2. Для яких пар елементів ДЕН має найбільше значення?
a) K і Ca; б) N і S; в) P і Cl; г) Na і F.
3. Хімічний зв’язок у молекулі дигідроген сульфіду (сірководню):
а) ковалентний полярний; б) металічний;
в) йоипий; г) ковалентний неполярний.
4. Формула речовини з ковалентним полярним зв’язком — це:
a) CaO; б) HF; в) N2; г) NaCL
5. Сполука з йонним хімічним зв’язком — це:
а) хлор(ІУ) оксид; б) гідроген хлорид;
в) магній фторид; г) нітроген(І) оксид.
6. Формула речовини з ковалентним неполярним зв’язком — це:
a) PH3; б) Cl2; в) Ca; г) N0.
7. У якій зі сполук довжина хімічного зв’язку найбільша?
а) С—Н; б) N—Н; в) Н—О; г) Н—F.
8. Формула речовини з найбільшим ступенем йониості хімічного зв’язку — це:
a) Na2O; б) MgO; в) Al2O3; г) BeO.
9. У якому ряді сполуки розташовані в порядку збільшення йониості хімічного зв’язку?
a) FeO, MgO, Al2O3; б) MgCl2, CaCl2, BaCl2;
в) Li2S, Na2S, K2S; г) CaF2, MgF2, BaF2.
10. У якому ряді сполуки розташовані в порядку зменшення полярності ковалентного зв’язку?
a) CH1, CBr1, CCl1, CF1; б) SiH1, PH3, H2S, HCl;
в) SiO2, P2O5, SO2,ClO2; г) AsH3, H2S, NH3, HF.
11. Ковалентний неполярний зв’язок характерний для молекул усього ряду речовин:
a) F2, N2, S8, P1; б) CO, NO, SiO, O3;
в) He, Ne, Ar, Ne; г) HF, HCl, HBr, HL
12. Хімічний елемент, в атомі якого електрони по енергетичних рівнях розподілені як 2, 8, 8, 1, утворює з елементом, в атомі якого електрони по енергетичних рівнях розподілені як 2, 8, 6, такий хімічний зв’язок:
а) ковалентний полярний; б) металічний;
в) ковалентний неполярний; г) йонний.
13. Речовина з молекулярними кристалічними ґратками — це:
а) алмаз; б) йод;
в) калій фторид; г) алюміній.
14. Речовина з атомними кристалічними ґратками — це:
а) мідь; б) натрій оксид;
в) «сухий лід» (твердий CO2); г) алмаз.
15. Речовина з йонними кристалічними ґратками — це:
а) срібло; б) графіт;
в) кальцій фторид; г) силіцій(ІУ) оксид.
16. Елемент за яким атомним номером із наведених нижче має найменше значення енергії йоиізації?
а) 3; б) 4; в) 8; г) 19.
17. Одинарний (простий) ковалентний зв’язок характерний для молекули:
а) азоту; б) карбон(ІУ) оксиду;
в) гідроген хлориду; г) натрій оксиду.
18. Атом якого елемента неспроможний підвищувати свою валентність у збудженому стані?
а) Нітрогену; б) Бору; в) Хлору; г) Фосфору.
19. Елемент за яким атомним номером із наведених нижче має найбільше значення спорідненості до електрона?
а) 20; б) 26; в) 31; г) 35.
20. У якій із наведених сполук ступінь окислення атома Хлору дорівнює +4:
a) Cl2O; б) ClO2; в) ClO3; г) Cl2O7?
Найважливіше в розділі З
• Об’єднання атомів у молекулу здійснюється завдяки хімічному зв’язку. Сили, які сполучають окремі атоми під час їхнього зіткнення й подальшої взаємодії в молекули, йоии або кристали, називають хімічним зв’язком.
• Під час утворення хімічного зв’язку атоми прагнуть змінити кількість електронів на зовнішньому енергетичному рівні та-
ким чином, щоб їх було вісім, а для атома Гідрогену — два. Атоми віддають або приймають електрони (йонний зв’язок) чи утворюють спільні електронні пари (ковалентний зв’язок).
• Хімічний зв’язок, який виникає в результаті утворення однієї або кількох пар електронів, спільних для двох атомів, називають ковалентним. Ковалентний зв’язок між атомами одного елемента є неполярним, а між атомами різних елементів — полярним. Спільна електронна пара в разі полярного зв’язку зміщується в бік атома більш електронегативного елемента.
• Заряджений атом чи групу атомів називають йоном. Розрізняють катіони — позитивно заряджені йоии та аніони — негативно заряджені йоии.
• Спроможність атома в хімічній сполуці притягувати валентні електрони інших атомів називають електропегативністю.
• Йонний зв’язок виникає між протилежно зарядженими йопа-ми в результаті їхнього електростатичного притягання. Речовини з переважно йоиним типом зв’язку за звичайних умов тверді, крихкі, мають високі температури плавлення й кипіння. До йонних сполук не застосовують поняття «молекула» та «валентність».
• Тверді речовини бувають кристалічними та аморфними. У кристалічних речовинах частинки строго впорядковані й утворюють кристалічні ґратки, в аморфних речовинах — розташовані хаотично.
• Основні типи кристалічних ґраток — атомні, йонні та молекулярні. Вони відрізняються видом хімічного зв’язку між частинками.
• Кількість енергії, необхідної для відриву електрона від ие-збудженого атома з перетворенням його па позитивно заряджений йои, називають енергією йопізації. Спроможність атомів віддавати електрони вважають мірою металічності елемента. Найменшу енергію йопізації мають лужні металічні елементи.
• Кількість енергії, яка виділяється внаслідок приєднання електрона до атома з перетворенням його на негативно заряджений йон, називають спорідненістю до електрона. Найбільшу спорідненість до електрона мають типові иеметалічпі елементи, найменшу — типові металічні елементи.
• Валентність — це число хімічних зв’язків, утворених атомом у молекулі. Поняття «валентність» застосовують тільки до елементів, що утворюють ковалентні зв’язки. Валент-
ність атома дорівнює числу утворених ним з іншими атомами спільних електронних пар або числу неспарених електронів у нормальному чи збудженому сталі па його зовнішньому енергетичному рівні.
• Ступінь окислення — умовний заряд на атомі в молекулі чи кристалі, який обчислюють, припускаючи, що всі полярні зв’язки мають йонний характер. Ступінь окиснення може мати як позитивне, так і негативне значення. У простих речовинах ступінь окиснення дорівнює нулю. Поняття «ступінь окиснення» застосовують до сполук як із ковалентним, так і з йопним зв’язком.
Це матеріал з підручника Хімія 8 клас Бутенко
Автор: admin от 19-10-2016, 20:05, Переглядів: 5456