§ 28. Полярний ковалентний зв'язок. Полярність, довжина, напрямленість ковалентного зв'язку
У цьому параграфі ви дізнаєтеся:
• чим полярний ковалентний зв'язок відрізняється від неполярного;
• що є мірою полярності зв'язку;
• про основні характеристики ковалентного зв'язку.
Полярний ковалентний зв’язок. У попередньому параграфі ми розглянули утворення молекул простих речовин із ковалентним неполярним зв’язком. Але ковалентний зв’язок може виникнути і між атомами різних неметалічиих елементів під час їхнього зіткнення.
Розглянемо, як утворюється молекула складної речовини — гідроген фториду HF. Атом Гідрогену має на зовнішньому енергетичному рівні один иеспарений електрон, а атому Флуору до завершення зовнішнього енергетичного рівня не вистачає одного електрона. У молекулі гідроген фториду HF атом H за рахунок чужого електрона завершує свій перший енергетичний рівень, а атом F — другий.
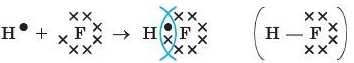
Ураховуючи розподіл електронів по підрівиях в атомів Гідрогену (Is1) і Флуору (2s22p5) утворення ковалентного зв’язку можна подати в такому вигляді:

А як розташовуються спільні електронні пари, утворені в результаті взаємодії між атомами різних неметалічних елементів?
У такому випадку спільні електронні пари зміщуються в бік того атома, який сильніше притягує електрони, тобто виявляє більшою мірою неметалічні властивості. Ковалентний зв’язок, який виникає між атомами різних елементів, називають
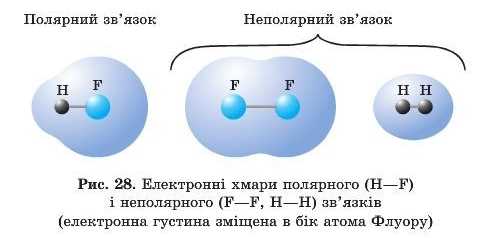
полярним. Чим більше зміщується спільна електронна пара, тим більша полярність зв’язку (рис. 28).
Для якісної характеристики полярності зв’язку ввели поняття електронегативності елемента.
Електронегативність елемента — це спроможність його атомів притягувати до себе спільні електронні пари в хімічній сполуці.
Для зручності розрахунків замість абсолютних значень електронегативності використовують відносну електронега-тивність4. Таким чином, це умовна безрозмірна характеристика атома елемента. Позначають грецькою літерою % (хі). Числові значення відносної електронегативності деяких елементів наведено в табл. 14.
Таблиця 14
Відносна електронегативність деяких елементів
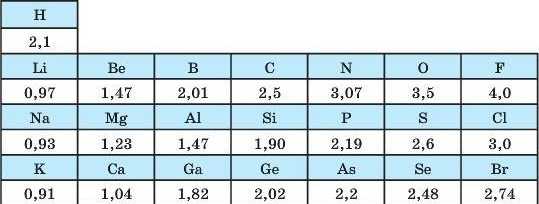
Зі збільшенням атомного номера елемента та ускладненням електронної структури атома відносна електроиега-тивність зростає: у періодах — зліва направо, а в головних
підгрупах — знизу вверх. Найменші значення відносної елек-тронегативності мають лужні металічні елементи, найбільшу — галогени.
Чим більша відносна електропегативність елемента, тим сильніше ядра його атомів притягують електрони та важче їх віддають, тобто вона є мірою неметалічних властивостей елемента. Найбільшу відносну електропегативність мають атоми Флуору F (4,0), тому вій і є найтиповішим неметалічним елементом. Найменшу відносну електропегативність, що дорівнює 0,7, мають атоми таких елементів, як Цезій Cs і Францій Fr, тому вони і є найтиповішими металічними елементами.
За значенням відносної електропегативиості атоми хімічних елементів молена розташувати в ряд, який починається з найактивніших неметалічних елементів і закінчується найактивнішими металічними елементами:

Наприклад, під час утворення молекули гідроген хлориду HCl спільна електронна пара зміститься в напрямку атома Хлору, бо його відносна електропегативність х(С1) = 3,0, а відносна електропегативність атома Гідрогену х (H) = 2,1. Умовно це позначають таким чином:
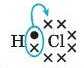
Чим більша різниця відносних електронегативностей (Дх) атомів, сполучених у молекулу, тим сильніше зміщуються спільні електронні пари в напрямку атома більш електронегативного (иеметалічного) елемента й тим більша полярність хімічного зв’язку. За відомою відносною електронегативністю елементів можна спрогнозувати, чи будуть їхні атоми утворювати сполуку. Так, у молекулі гідроген ціаніду
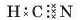
атом Нітрогену притягує до себе спільні електронні пари, утворені ним з атомом Карбону, а атом Карбону — спільну електронну пару, утворену' з атомом Гідрогену.
У формулах складних сполук хімічний знак менш електронегативного елемента здебільшого пишуть першим, наприклад HCl (виняток NH3, CH1 тощо).
Характеристики ковалентного зв’язку. Крім полярності та кратності» ковалентний зв’язок характеризують і такою його властивістю, як довжина зв'язку. Це — відстань між ядрами атомів у молекулі. Атоми наближаються на таку відстань, за якої досягається найбільше перекриття їхніх електронних хмар (0,1-0,2 им), а енергія молекули стає мінімальною. Найменшою є довл<ина зв’язку в молекулі водню H2 — 0,074 нм, тому що атом Гідрогену має найменший радіус. Довжина зв’язку залежить також від того, який це ковалентний зв’язок — одинарний, подвійний чи потрійний (рис. 29).
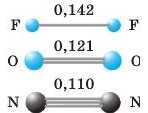
Рис. 29. Порівняння довжин зв’язку (нм) у деяких молекулах на прикладі кулестрижневих моделей (кулі позначають ядра атомів, а стрижні — хімічні зв’язки; у реальних молекулах простір між ядрами заповнений електронними хмарами, які на цих моделях не показано)
Довжина зв’язку в молекулах, утворених атомами елементів одного й того самого періоду, зменшується, якщо число ковалентних зв’язків між ними зростає. Відповідно до цього зростає й міцність зв’язку, а отже, і молекули. Мірою міцності зв’язку є його енергія.
Енергія зв'язку — це кількість енергії, яка потрібна для того щоб розірвати зв’язок і розділити молекулу на частини.
Енергія молекули завжди менша від сумарної енергії атомів, що її утворюють. Тому під час утворення зв’язку енергія завжди виділяється, а під час розриву поглинається. Різні ковалентні зв’язки мають різну міцність. Так, кількість енергії,
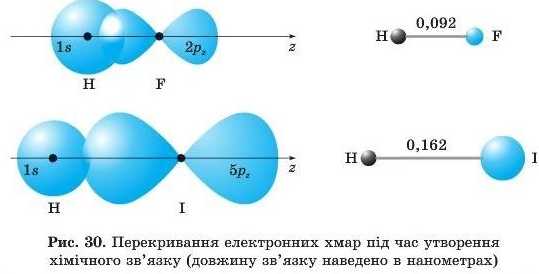
яку треба витратити на розрив зв язку між атомами в молекулі F2 (одинарний зв’язок) майже в шість разів менша від потрібної для розриву потрійного зв’язку в молекулі Nr Хімічний зв’язок тим міцніший (відповідно його енергія тим більша), чим сильніше перекриваються електронні хмари атомів — молекула HF міцніша за молекулу НІ (рис. ЗО).
Для ковалентних зв’язків характерною є певна їх напрям-леність у просторі, оскільки електронні хмари атомів мають певне просторове розташування, або просторову орієнтацію. Геометричну форму молекули визначає прагнення електронних пар розміщуватися в просторі якомога далі одна від одної.
Так, будь-яка двохатомна молекула (H2, F2, HF) має лінійну форму, через те що ядра двох атомів завжди перебувають на одній прямій лінії, незалежно від того, які електронні хмари (s- або р-) беруть участь в утворенні ковалентного зв’язку (див. рис. 29, ЗО).
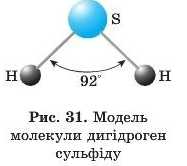
А тепер розглянемо трьохатомну молекулу, наприклад дигі-дрогеи сульфіду H2S в атомі Сульфуру, електронна конфігурація якого ls22s22p63s23p*, два непарних р-електрони рухаються по взаємно перпендикулярних орбіталях (наприклад, рг) і р). У разі взаємодії з атомами Гідрогену утворюються два хімічних зв’язки S—Н. У молекулі дигідроген сульфіду H2S вони утворюють кут, який також має дорівнювати 90°. Кут між зв'язками, або валентний кут, — це кут між умовними лініями, що сполучають хімічно зв’язані атоми. Через взаємне відштовхування електронних хмар атомів Гідрогену валентний кут між його атомами дещо зростає — з 90° до 92° (рис. 31). Таким чином, молекула дигідроген сульфіду має кутову просторову форму.

Лайнус Полінг (1901-1994)
Відомий американський хімік і фізик. Його найважливіші наукові роботи присвячені дослідженню будови молекул і природи хімічного зв’язку. Він висунув ідею про гібридизацію (змішування) атомних орбіталей, створив шкалу електронега-тивності хімічних елементів.
У 1954 році був удостоєний Нобелівської премії з хімії.
• Приклади розв’язування задач ^ш Приклад 1. У молекулі якої сполуки — гідроген фториду чи гідроген хлориду — полярність ковалентного зв’язку вища, якщо % (Ii) = 2,1, % (F) = 4,0, х (Cl) = 3,0?

Приклад 2. Яка електронна та графічна формули молекули H2O? До атома якого елемента зміщено спільні електронні пари?
Розв'язання
1. Знаходимо символи елементів Гідрогену й Оксигену в періодичній системі елементів. Гідроген — елемент ІА-групи першого періоду періодичної системи елементів. Це означає, що па зовнішньому енергетичному рівні атома Гідрогену міститься один електрон (число електронів на зовнішньому рівні дорівнює номеру групи), вій є песпареиим. Число иеспарених електронів визначають як різницю між максимально можливим числом електронів на зовнішньому енергетичному рівні (для елементів першого періоду це 2) і номером групи: (2 - 1) = 1.
Оксиген — елемент VIA-групи другого періоду, тому число електронів на зовнішньому енергетичному рівні — шість. Максимальне число електронів па зовнішньому енергетичному рівні для елементів другого та всіх інших періодів — вісім, тому число песпарених електронів в атомів Оксигену дорівнює (8 - 6) = 2.
2. Електрони зовнішнього енергетичного рівня, тобто валентні, умовно позначимо точками навколо символу елемента Гідрогену та хрестиками — навколо символу елемента Оксигену:
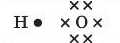
Як бачимо, до завершення зовнішньої електронної оболонки (шару) в атомі Гідрогену не вистачає одного електрона, а в атомі Оксигену — двох. Через це атому Гідрогену достатньо вступити у взаємодію лише з одним атомом Оксигену, а останньому — із двома атомами Гідрогену. Унаслідок цього під час утворення
Дві інші електронні пари атома Оксигену (позначені двома хрестиками) не беруть участі в утворенні хімічного зв’язку. Це так звані неподілені пари. Отже, з електронної формули видно, що кожний з атомів Гідрогену має на зовнішньому енергетичному рівні по два електрони (Is2), спільні з атомом Оксигену. Атом Оксигену, у свою чергу, має вісім електронів (2s22p6) — чотири своїх і дві спільні пари. Кожен з атомів має стабільну електронну структуру атома найближчого інертного елемента.
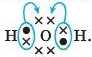
молекули H2O виникають дві спільні електронні пари (позначені точкою та хрестиком):
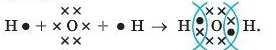
3. Електропегативпіть атома Оксигену — 3,5, а атома Гідрогену — 2,1. Тому спільні електронні пари зміщені до атома Оксигену як до більш електронегативного. Це в разі написання електронної формули молекули H2O умовно можна позначити таким чином:
Графічна (структурна) формула молекули води: H—O—Н.
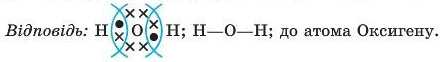
Запитання та завдання
1. Який ковалентний зв’язок називають полярним?
2. Запишіть формули речовин у послідовності зростання полярності зв’язку: H2O, CH1, H2, NH3.
3. Обчисліть різницю відносних електроиегативпостей атомів, які утворили ковалентні зв’язки: а) В—СІ; б) C—СІ; в) N—СІ; г) O—СІ; ґ) F—Cl. Укажіть, який зв’язок має найбільшу полярність, який — найменшу.
4. Використовуючи значення відносної електронегативності, наведені в табл. 14, виберіть формулу найполярнішої молекули: H2, НС1, HF, C1F, Cl2, F2.
5. Використовуючи значення відносної електронегативності, що наведені в табл. 14, виберіть формулу найполярнішої молекули: H2, HCl, HF, H2O, Cl2, F2.
6. Як скласти схеми утворення хімічних зв’язків для молекул Cl2 і H2S? Який тип ковалентного зв’язку реалізується під час утворення кожної з цих молекул? Якою є при цьому валентність коленого з атомів, що взаємодіють? Чому в кожного з атомів виникає потреба в утворенні цього зв’язку?
7. Які з наведених речовин NH3, Br2, CH1, H2 утворилися за рахунок полярного ковалентного зв’язку, а які — неполярного ковалентного зв’язку? Які їхні електронні та графічні формули?
8. Який вигляд матимуть електронні та графічні формули молекул Cl2O і H2O? У якій із цих молекул хімічний зв’язок є більш полярним і в бік якого з атомів зміщується спільна електронна пара?
9. Дано три електронні формули:
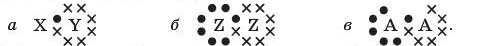
Які з наведених формул речовин можуть відповідати кожній із них: NH3, НС1, O2, F2, N2, H2, HBr, Cl2?
10. Чи може ковалентний зв’язок між атомами різних пе-металічпих елементів наближатися до ковалентного неполярного, наприклад, у молекулі фосфіну PH3? Яка полярність хімічного зв’язку в молекулі цієї сполуки, якщо значення електроиегативності атомів Фосфору й Гідрогену дорівнюють відповідно 2,2 і 2,1?
11. Скориставшись знаннями про електронну структуру атомів Гідрогену й Оксигену, розкажіть за схемою 3 про утворення хімічних зв’язків у молекулі води.
Схема З
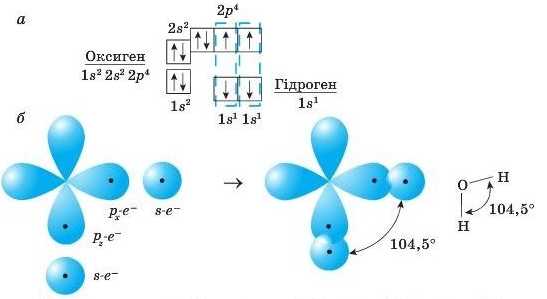
Будова електронних оболонок атомів Оксигену й Гідрогену (а). Утворення зв’язків у молекулі води (б)
12. Які з молекул O2, НС1, H2S, H2, H2O, Cl2 мають: а) лінійну форму; б) кутову форму?
Це матеріал з підручника Хімія 8 клас Бутенко
Автор: admin от 19-10-2016, 19:58, Переглядів: 5140