§ 26. Природа хімічного зв'язку
У цьому параграфі ви дізнаєтеся:
• чому атоми об'єднуються в молекули, йони, кристали;
• чому деякі елементи не утворюють молекул ні за яких умов;
• як здійснюється хімічний зв'язок між атомами.
Хімія — це наука, одним із найважливіших завдань якої є вивчення механізму утворення, складу й будови речовини. Тому вчені постійно замислювалися над проблемою, чому в більшості випадків атоми різних елементів існують не самі по собі, нарізно, а сполучаються з іншими атомами й утворюють молекули (O2, O3, P1, S8), йони (PO*-, SO2-, B4O?-), кристали (наприклад, Na6Clf або спрощено NaCl). І лише атоми таких інертних елементів, як Гелій Не, Неон Ne та Аргон Аг, не сполучаються ані між собою, ані з атомами інших елементів. Відповісти на це запитання стало можливим тільки після відкриття складної структури атома й встановлення будови його електронних оболонок (епергетичних рівнів).
Нагадаємо, що атоми інертних елементів Неону Ne, Аргону Аг, Криптону Kr, Ксенону Хе, Радону Rn мають на зовнішньому енергетичному рівні максимальне число електронів, яке дорівнює восьми. Тільки атом Гелію має два, бо в нього всього один енергетичний рівень, який може вмістити не більше двох електронів. Електронні структури зовнішніх енергетичних рівнів тих атомів, що складаються з максимального числа електронів (двох — в елементів першого періоду та восьми — в елементів решти семи періодів періодичної системи елементів), назвали стабільними, або завершеними. Цим пояснили хімічну інертність благородних газів He, Ne та Аг, тобто неспроможність їх до сполучення з іншими атомами для завершення своїх зовнішніх енергетичних рівнів, бо вони в них усі завершені.
Атом Гідрогену має менше ніж два електрони, а атоми решти елементів — менше ніж вісім. Через це такі атоми прагнуть набути електронної структури інертних елементів, тобто
перейти в стійкіший стаи. Це можна здійснити в разі взаємодії атомів між собою.
Сукупність сил, які сполучають окремі атоми під час їхнього зіткнення й подальшої взаємодії в молекули, йони або кристали, називають хімічним зв'язком.
Взаємодію між атомами пояснюють їхнім прагненням завершити свої зовнішні енергетичні рівні до двох- або восьми-електроиної структури, оскільки така структура має найменшу енергію, а отже, є стабільною.
Електрони, які беруть участь в утворенні хімічного зв’язку, тобто створенні завершеної електронної структури атомів, називають валентними. Валентні електрони — це неспареиі електрони зовнішнього енергетичного рівня. До них відносять і ті спарені електрони, що спроможні розпарюватися й розміщуватися на вільних орбіталях.
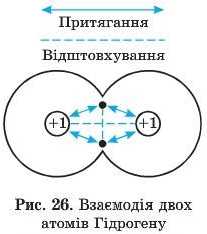
Розглянемо процес утворення молекули водню H2. Атом Гідрогену містить усього один електрон, який розташований на першому енергетичному рівні й займає ls-орбіталь. Під час зближення двох атомів Гідрогену, що мають електрони з протилежними спінами, позитивно заряджене ядро одного атома притягує не тільки свій електрон, але й електрон другого атома, і навпаки. Отже, кожний із двох електронів притягується одночасно двома ядрами (рис. 26). Це і є причиною того, що атоми утримуються разом.
Таке групування є стабільнішим, ніж окремі атоми, у яких кожний електрон притягується тільки одним ядром. Однак слід зазначити, що під час зближення двох атомів виникає й відштовхування: через однойменні заряди обидва електрони відштовхуються один від одного. Те саме відбувається й між протонами (ядрами), у результаті чого атоми віддаляються. Відштовхування протонів запобігає подальшому зближенню двох атомів Гідрогену. Нарешті атоми опиняються на певній відстані один від одного. Дві електронні хмари об’єднуються у єдину електронну хмару молекули (рис. 27). Електронна густина між ядрами атомів збільшується, тобто кожний із двох електронів більшу частину часу проводить у просторі між ядрами. Електронна структура кожного з атомів Гідрогену
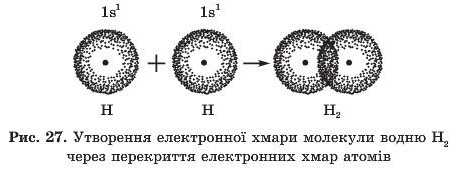
доповнюється до структури атома Гелію. Утворюється хімічний зв’язок.
Виникає запитання: чому ці атоми взаємодіють? У взаємодії атомів виявляється одна із загальних закономірностей природи: переважна більшість систем прагне до зменшення своєї енергії, щоб набути більшої стійкості. Окремі атоми мають деякий запас енергії. Під час утворення зв’язку між цими атомами частина енергії виділяється. Молекула має менший запас енергії, а тому вона стійкіша, ніж атоми.
На якій відстані між ядрами атомів досягається максимальне перекривання їхніх електронних хмар? Ця відстань є порівняною з розмірами атомів і в молекулі водню H2 становить 0,076 пм (або 7,6*10 11 м). Саме завдяки цій відстані між ядрами атомів енергія молекули є мінімальною.
Не всі атоми можуть взаємодіяти між собою. Трапляється так, що під час зближення атомів, наприклад, Гелію їхні електронні хмари не перекриваються, спільна енергія зростає й молекула утворитися не може. Це відбувається через те, що в атомів Гелію зовнішній енергетичний рівень завершений і їм не потрібні електрони інших атомів.
Запитання та завдання
1. Чому число відомих молекул набагато перевищує число хімічних елементів?
2. Яка елементарна частинка бере участь в утворенні хімічного зв’язку?
' 3. Які сили діють у молекулі ВОДНЮ H2?
4. Що таке хімічний зв’язок? Чому він утворюється?
5. Чому атоми одних елементів взаємодіють між собою, а інші — ні?
6. Скільки електронів не вистачає до восьми в атомах Нітрогену, Карбону, Сульфуру, Хлору?
7. Які електронні структури зовнішніх енергетичних рівнів атомів називають стабільними, або завершеними? В атомах яких елементів вони реалізуються? Наведіть приклади.
8. Як називають сили, що сполучають окремі атоми під час їхнього зіткнення?
9. Як називають електрони, що беруть участь в утворенні хімічного зв’язку?
10. Молекула порівняно з атомами, що входять до її складу, має: а) більшу енергію; б) меншу енергію; в) таку саму. Виберіть правильне твердження.
11. Під час утворення хімічного зв’язку між атомами енергія:
а) поглинається; б) виділяється. Виберіть правильне твердження.
12. Молекула водню утворюється лише тоді, коли в атомів Гідрогену, що взаємодіють, електрони мають: а) паралельні спіни; б) антипаралельні спіни. Виберіть правильне твердження.
13. У разі утворення хімічного зв’язку електронні хмари атомів, що взаємодіють: а) перекриваються одна одною;
б) відштовхуються одна від одної. Виберіть правильне твердження.
Це матеріал з підручника Хімія 8 клас Бутенко
Автор: admin от 19-10-2016, 19:57, Переглядів: 1889