§ 22. Електронні структури атомів. Довга форма періодичної системи хімічних елементів
У цьому параграфі ви дізнаєтеся:
• за якими правилами заповнюються електронами енергетичні рівні;
• у якій послідовності заповнюються електронами орбіталі елементів перших чотирьох періодів періодичної системи;
• що таке електронна структура атома;
• чим коротка форма періодичної системи відрізняється від довгої.
Правила заповнення атомних орбіта лей. Орбіталі атома відповідно до стану електрона заповнюються за такими правилами.
1. Згідно з принципом мінімальної енергії електрони в атомі прагнуть зайняти в першу чергу енергетичні рівні, розташовані ближче до ядра (тобто в послідовності 1, 2, 3...), а також їхні орбіталі простішої форми, які характеризуються меншим запасом енергії. Потім відбувається заповнення більш віддалених від ядра і складніших за формою атомних орбіталей. Цей принцип розкрито в правилах Клечковського.
Згідно з першим із них:
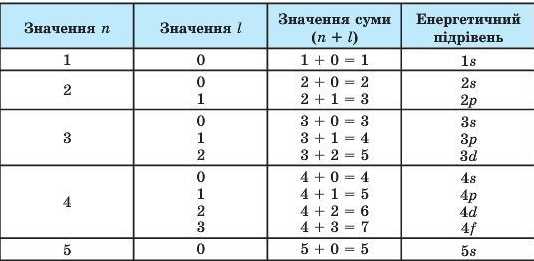
електрони заповнюють енергетичні підрівні за зростанням їхньої енергії, яка характеризується мінімальним значенням суми квантових чисел(п + /):
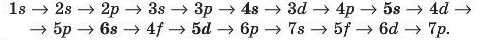
За другим правилом:
якщо сума квантових чисел(п + /) для декількох різних підрівнів (наприклад, для 4/, 5d, 6р, 7s) однакова, то першими заповнюються підрівні з меншим значенням п:
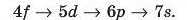
2. Принцип Паулі дозволяє перебувати на кожній орбіталі не більш як двом електронам. Вони мають відрізнятися один від одного напрямком обертання електронів навколо власної осі (за годинниковою стрілкою або проти неї), яке називають спіном. Електрони з протилежними спінами позначають стрілками T і 4', спрямованими в протилежні боки. Два електрони з протилежними (аитипаралельпими) спінами на одній орбіталі називають спареними. Такий їхній стан в атомі є енергетично вигіднішим. Спарені електрони однієї орбіталі умовно позначають стрілками Tji. Якщо на орбіталі перебуває один електрон, то його вважають неспареним.
3. За правилом Гунда кожна орбіталь одного підрівня спочатку заповнюється поодинокими (неспареними) електронами з паралельними спінами. Після того як такі електрони займуть усі вільні орбіталі даного підрівня, відбувається їхнє спарювання.
Розглянемо, як заповнюються електронами орбіталі елементів перших чотирьох періодів періодичної системи.
Заповнення атомних орбіталей елементів малих періодів.
Перший період містить два елементи — Гідроген і Гелій.
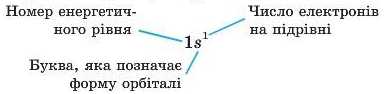
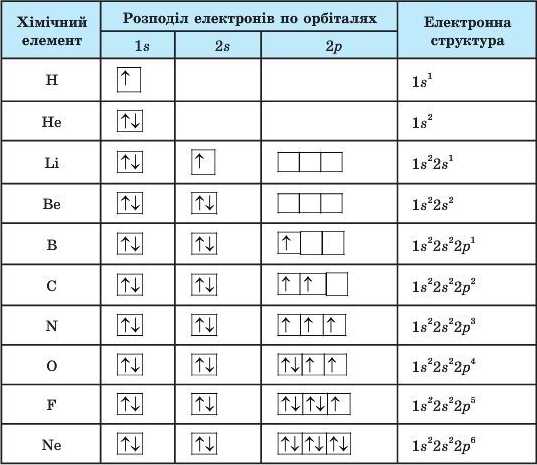
Атом Гідрогену (Z = 1) має один електрон, який займає на першому енергетичному рівні орбіталь із найнижчою енергією — ls-орбіталь:
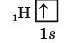
Крім графічного зображення електронної структури атома — електронної конфігурації,можна складати також електронні формули,у яких записують спочатку цифру, що відповідає ио-меру рівня, потім букву, яка позначає підрівень. Поряд з кожною буквою праворуч угорі записують цифру, що відповідає числу електронів на даному підрівпі:
В атомі Гелію на один електрон більше і s-орбіталь займають два електрони, які мають антипаралельні спіни:
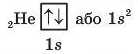
На цьому заповнення електронами першого енергетичного рівня завершується.
Електрони атомів елементів другого періоду розташовані на двох енергетичних рівнях (номер періоду визначає число енергетичних рівнів). Період починається лужним металічним елементом Літієм Li (Z = 3). Два електрони атома Літію перебувають на першому рівні, як в атомі Гелію, а третій електрон починає заповнювати вільну 2я-орбіталь другого енергетичного рівня:
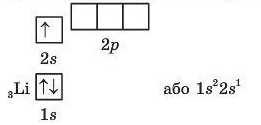
На другому енергетичному рівні відповідно до формули N = 2п2можуть розміститися максимально вісім електронів (2 • 22 = 8). Цей рівень, окрім s-підрівпя, має ще р-підрівеиь, максимальна місткість якого — шість електронів. Тому енергетичні рівні заповнюються послідовно електронами від одного до восьми. І дійсно, в атомі Берилію Be на s-підрівпі розміщуються вже два електрони: 2s2. Отже, 2з-підрівеиь завершений.
Починаючи з атома Бору В, відбувається заповнення р-під-рівнів другого енергетичного рівня (від одного р-електропа в атомі Бору до шести р-електронів в атомі благородного газу Неону):
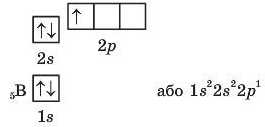
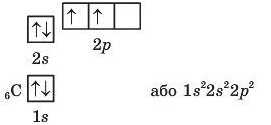
В атомі Карбону C (Z = 6) на один електрон більше, ніж в атомі Бору. Яку орбіталь він займе — вільну чи ту, де є вже електрон?Згідно з висновком із правила Гуида: у межах одного підрівня електрони розташовуються так, щоб число не-спарених електронів було максимальним.
Електрони прагнуть зайняти вільні орбіталі, тому атом Карбону має два иеспарених електрони:
В атомі Нітрогену сьомий електрон займає ще одну вільну 2р-орбіталь, а в атомах Оксигену, Флуору й Неону електрони займають 2р-орбіталі, на яких уже є по одному електрону. Другий рівень завершено. Такий розподіл електронів в атомів перших десяти елементів наведено в табл. 9.
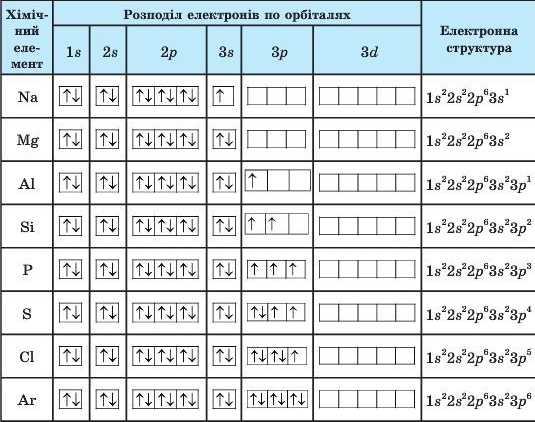
Третій періодпочинається з Натрію Na (Z = 11). З 11 електронів, розташованих на трьох енергетичних рівнях, два перебувають на першому енергетичному рівні — Is2 (як в атомі Гелію), вісім — на другому — 2s22pG (як в атомі Неону). Останній одинадцятий електрон розташований на s-підрівні третього рівня — ls22s22pG3s'. В атомі Магнію Mg на s-підрівні третього рівня є вже два електрони — ls22s22pG3s2 (табл. 10).
Таблиця 9
Електронні структури атомів елементів першого й другого періодів
На третьому енергетичному рівні згідно з формулою N = 2п можуть розташуватися ЛГ = 2*32=18 електронів, тому що, крім S- і р-підрівней, вони можуть займати й наступний d-підрівень. Але оскільки число елементів у цьому періоді не перевищує восьми, то зі зростанням заряду ядра атомів від Натрію до Аргону число електронів на зовнішньому рівні збільшується від 1 до 8.
Починаючи з Алюмінію AI і закінчуючи Аргоном Аг, в елементів третього періоду (окрім Зя-орбіталі, яку вже заповнено двома електронами) відбувається послідовне заповнення р-орбіталей, або Зр-підрівпя. Розміщення максимально можливого числа електронів для елементів третього періоду відбулося — 8 в атомі Аргону, проте d-еиергетичпий підрівепь у цих елементів залишився незавершеним (табл. 10).
Таким чином, доходимо висновку: будова внутрішніх енергетичних рівнів елементів кожного нового періоду повторює електронну структуру (розташування електронів) благородного
Електронні структури атомів елементів третього періоду
газу, яким закінчується попередній період. Через це часто використовують короткий запис електронних структур атомів. Наприклад, для елементів другого періоду такий:
Літій — [He]2s\ Оксиген — [Не]2я*2р4, для елементів третього періоду такий:
Натрій — [Ne]3s‘, Магній — [Ne]3s2, Алюміній — [Ne]3s23p‘ тощо.
Якщо порівняти електронну будову атомів, то можна помітити, що структура зовнішніх енергетичних рівнів періодично повторюється, наприклад: Літій — 2s1 і Натрій — 3s1; Берилій — 2s2 і Магній — 3s2; Бор — Ss2Spi і Алюміній — Ss2Spi тощо. Така закономірність зберігається і в наступних періодах. Саме цим пояснюють періодичну повторюваність властивостей елементів у періодах.
Отже, у межах малих періодів відбувається заповнення зовнішнього енергетичного рівня електронами числом від 1 до 8. Передостанні рівні атомів завершені й відповідають електронним структурам атомів благородних газів попередніх періодів.
Таблиця 11
Формування електронних структур атомів перших чотирьох періодів за правилами Клечковського (принципом мінімальної енергії)
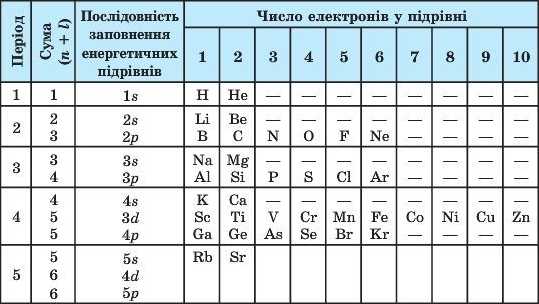
Заповнення зовнішніх енергетичних рівнів елементів великих періодів. На початку четвертого періоду стоїть Калій К. Після заповнення шістьма електронами Зр-підрівпя атома Аргону Ar в атомі Калію починає заповнюватися 4я-орбіталь, а не вільні Srf-орбіталі (табл. 11). Це відбувається тому, що для 4.9-підрівня сума квантових чисел тг + / = 4 + 0 = 4,а для Зс?-підрівня сума п + І = 3 + 2 = 5 (табл. 12). Відповідні електронні структури атомів Калію та Кальцію такі: K — [Ar]4s‘ і Ca — [Ar]4s2.
Після заповнення 4з-підрівня, згідно з другим правилом Клечковського, електрони заповнюють послідовно енергетичні підрівні 3d і 4р, які мають однакове значення суми квантових чисел п + І = 5, але різні значення п: так, для Зс?-підрівня п = З, а для 4р-підрівня п = 4. Наприклад, за даними табл. 11 електронні формули атомів Мангану й Цинку можна подати таким чином: Mn — [Ar]4s23cf, Zn — [Ar]4s23d10. Після завершення d-підрівня в атомі Цинку починає заповнюватися 4р-підрівень в атомі Галію: [Ar]4s23d104p‘ Тоді електронна формула Арсена, наприклад, має вигляд: As — [Ar]4s23d104p3. Заповнення 4р-підрівия закінчується в атомі Криптону: Kr — [Ar]4s23dl04p°.
В елементів п’ятого періоду Рубідію та Стронцію заповню-ється 5 S-під рівень: Sr — [Kr]5s .
Хімічні елементи, в атомах яких в останню чергу відбувається заповнення s-, р-, d- або /-підрівиів, називають відповідно S-, р-, d- та f-елементами. Іноді їх позначають певними
Сума квантових чисел (я + І) енергетичних підрівнів
кольорами в періодичній системі елементів. Кожний період періодичної системи, крім першого, починається s-елемеитом і закінчується p-елементом. /-Елементи (лантаноїди та актиноїди) винесено за межі періодичної системи короткої форми (див. форзац). Малі періоди та головні підгрупи складаються лише з S- і p-елементів. Усі d- і /-елементи розташовані в побічних підгрупах великих періодів.
Довга форма періодичної системи. У короткій, або 8-клітин-ковій, формі періодичної системи елементи головних і побічних підгруп розташовані в різних рядах одного періоду. У довгій, або 18-клітинковій, формі відсутні побічні підгрупи, через те що d-елемепти займають клітинки між s- і p-елементами. Схожість елементів, які знаходяться в різних підгрупах однієї групи в напівдовгій формі, виражається в тому, що відповідним підгрупам дають однакові номери, але з різними буквами: головним підгрупам — А, побічним — Б. Таким чином, періодична система такої форми містить 16 груп (табл. 13). А- і Б-групи об’єднують елементи в так звані родини електронних аналогів, які мають схожість і електронної структури, і хімічних властивостей.
Алгоритм складання електронних формул і схем атомів
1. Елемент, порядковий номер і символ.
2. Положення елемента в періодичній системі (період, група, підгрупа).
3. Кількість електронів, число енергетичних рівнів і підрівнів в атомі.
4. Послідовність заповнення атомних орбіталей електронами.
5. Складання електронних формул і схеми атома елемента.
Приклади розв’язування задач
Приклад 1. Опишіть електронну структуру атома Фосфору.
Розв'язання
1. Визначаємо положення Фосфору, наприклад, у короткій формі періодичної системи хімічних елементів: P — елемент № 15, 3-й період, V група, головна підгрупа.
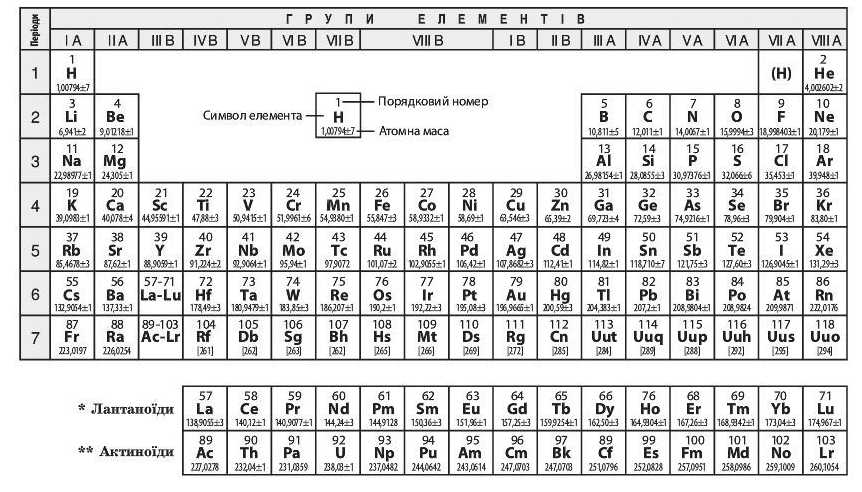
2. Зображуємо квантові комірки. Оскільки елемент Фосфор знаходиться в третьому періоді, то в його атомі заповнено електронами три енергетичних рівні. Атомному номеру елемента відповідає позитивний заряд ядра, який, у свою чергу, має бути скомпенсовалий негативно зарядженими електронами в електронній оболонці, оскільки атом є електронейтральним. Отже, в атомі Фосфору є 15 електронів, тоді на схемі маємо зобразити 15 стрілок у квантових комірках (орбіталях), розміщуючи їх за порядком, який описано вище.
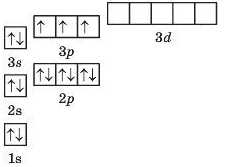
Таке зображення електронної структури атома ще називають графічним.
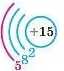
3. Наводимо схему, у якій зображено заряд ядра й розподіл електронів по енергетичних рівнях.
4. Записуємо електронну формулу, яка показує число електронів на кожному з підрівиів; підкреслюємо частину запису, що вказує на число електронів на зовнішньому енергетичному рівні:
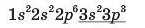
5. Указуємо тип елемента (або його приналежність до s-, р-, d- або /-родини) залежно від того, який енергетичний під-рівень заповнений електронами не повністю або заповнюється в останню чергу. Фосфор — p-елемент, тому що в його атомі, з одного боку, останнім заповнюється р-підрівень зовнішнього енергетичного рівня, а з другого — р-підрівень не повністю заповнений: замість максимального числа електронів, яке дорівнює шести, в атомі Фосфору па ньому всього 3 електрони.
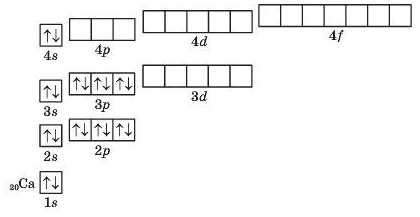
Приклад 2. Визначте електронну структуру атомів Кальцію та Брому. Укажіть тип елементів.
Розв'язання
Складемо схеми квантових комірок для атома Кальцію:
Схеми квантових комірок для атома Брому:
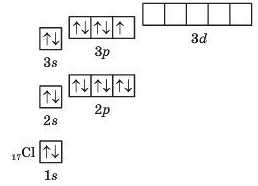
Кальцій — s-елемент, оскільки у його атомі останнім заповнюється s-підрівеиь. Бром — р-елемеит, бо у його атомі неповністю заповнений р-підрівень. Порівняйте з позначенням цих елементів у періодичній системі, наведеній на форзаці.
Приклад 3. Електронна формула атома Криптону 3GKr: ls22s22p63s23p°4s23d104pG. Яка електронна формула атома Рубідію 37Rb?
Розв'язання
Електронну формулу атома Рубідію можна записати таким чином:
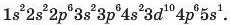
У разі заповнення rf-підрівня третього енергетичного рівня останнім електроном запас його енергії, згідно з правилом
Клечковського, характеризується такою сумою квантових чисел: (п + /)= 3 + 2 = 5, а в разі заповнення s-підрівня четвертого енергетичного рівня — сумою (д + /) = 4 + 0 = 4. Отже наведена електронна формула атома Рубідію відповідає правилу Клечковського, через те що сума чисел (п + /) 4з-електрона менша від суми (п + І)Зс/-електрона.
Запитання та завдання
1. Який запис розташування електронів на енергетичних рівнях і підрівиях атома будь-якого елемента називають його електронною структурою або електронною конфігурацією атома?
2. Електронну структуру якого елемента попереднього періоду повторює будова внутрішніх енергетичних рівнів елементів кожного нового періоду?
3. У чому полягає особливість заповнення електронами енергетичних рівнів в атомах елементів великих періодів?
4. Чому перший період містить усього два хімічних елементи, а другий — вісім?
5. Скільки електронів міститься на зовнішньому енергетичному рівні атомів таких елементів:
а) Літію, Карбону, Флуору;
б) Натрію, Силіцію, Хлору?
6. Скільки енергетичних рівнів зайнято електронами в атомах:
а) Літію, Натрію, Калію;
б) Берилію, Магнію, Кальцію;
в) Флуору, Хлору, Брому?
7. Назвіть два елементи, в атомах яких завершено всі енергетичні рівні.
* 8. Напишіть електронну структуру атома Оксигену. В атомі ще якого елемента другого періоду таке саме число пе-спарених електронів?
9. Які елементи об'єднують у так звані родини електронних аналогів? Чому? Наведіть приклади.
10. Ураховуючи порядок заповнення атомних орбіталей електронами, складіть схеми електронних конфігурацій атомів елементів № 6 і № 9.
11. Виконуючи самостійну роботу зі складання схеми розміщення електронів в атомі Нітрогену, учні написали таке:

Чи правильні такі записи? Якщо допущено помилки, роз’ясніть і виправте їх.
12. Який із підрівнів заповнюється в першу чергу:
a) os або 4d; б) 3d або 4s?
13. У чому полягає суть принципу мінімальної енергії? Як конкретно цей принцип розкритий у правилах Клечков-ського?
14. Як заповнюються електронами орбіталі атома відповідно до правила Гунда?
15. Зобразіть електронні структури атомів:
а) Сульфуру, Флуору, Натрію;
б) Силіцію, Нітрогену, Карбону;
в) Алюмінію, Оксигену, Аргону;
г) Бору, Магнію, Берилію.
В атомах яких елементів заповнення поодинокими електронами вільних орбіталей відповідає максимальному числу згідно з правилом Гунда? До якої родини елементів (s-, р- або d-) відносять атоми кожного з елементів?
16. Укажіть електронну структуру зовнішніх енергетичних рівнів атомів таких елементів:
а) № 20, 32, 39; б) № 22, 36, 55;
в) № 35, 37, 48; г) № 26, 51, 56;
ґ) № 24, 33, 55; д) № 38, 40, 31.
17*. Знайдіть елементи за такими електронними структурами:

18. Чим довга форма періодичної системи відрізняються від короткої?
Це матеріал з підручника Хімія 8 клас Бутенко
Автор: admin от 19-10-2016, 19:55, Переглядів: 17702