§ 18. Ізотопи стабільні і радіоактивні
У цьому параграфі ви дізнаєтеся:
• що таке ізотопи;
• чому відносну атомну масу елементів позначають дробовими числами.
Ізотопи. З аналізу даних, наведених у періодичній системі, видно, що відносні атомні маси хімічних елементів мають дробові значення, причому зі збільшенням атомного номера атомна маса елементів зростає. Однак спостерігається деяке порушення закономірності: у парах елементів Аргон—Калій, Кобальт— Нікель, Телур—Йод, Торій—Протактиній елемент, що стоїть попереду, має більшу відносну атомну масу, ніж наступний.
Виникають запитання: чому маси позначено дробовими числами, якщо маси протонів і нейтронів прийнято за І, а масою
електронів можна знехтувати? Яка причина порушень послідовного зростання атомних мас від елемента до елемента?
Дослідження показали, що в природі існують атоми одного й того ж самого елемента, але з різною масою. Наприклад, відомі атоми Хлору з масою 35 і 37. Однак заряд ядер цих атомів однаковий, тобто вони містять однакове число протонів Z4 тому відрізняються між собою лише числом нейтронів N.
Різновиди атомів одного елемента, що мають однакові заряди ядер, але різні маси (масові числа), називають ізотопами.
Слово «ізотоп» складається з двох грецьких слів: ізос — «один» і топос — «місце». Ізотопи займають одне місце (клітинку) у періодичній системі елементів Д. І. Менделєєва.
Атоми всіх ізотопів одного й того самого елемента мають однакове число протонів та електронів, а відрізняються один від одного тільки числом нейтронів. У табл. 6 наведено характеристики ізотопів елемента Карбону.
Таблиця 6
Характеристики ізотопів елемента Карбону
|
Ізотопи (позначення) |
Атомний номер (число протонів) Z |
Число нейтронів N |
Масове число А |
 |
6 |
6 |
12 |
 |
6 |
7 |
13 |
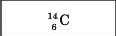 |
6 |
8 |
14 |
Відомі ізотопи 94 природних елементів. Так, Оксиген має три ізотопи з масовими числами 16, 17 і 18. їх позначають відповідно 1JO, 1JO і 1JO, де 8 — це протонне число, а 16, 17 і 18 — ну-клонні числа.
Відносна атомна маса хімічного елемента (Ar) дорівнює середньому значению мас усіх його природних ізотопів з урахуванням їхньої поширеності в природі.
Так, наприклад, масова частка ізотопу Хлору Cl у природі становить 24,23 %, а масова частка природного ізотопу Хлору J;’C1 — 75,77 %. Отже, середня відносна атомна маса Хлору дорівнюватиме:
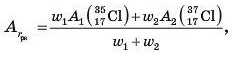

Таким чином, відносні атомні маси елементів (А,.), що наведені в періодичній системі, являють собою середні масові (ну-клонпі) числа природних сумішей ізотопів. Це одна з причин того, чому значення відносних атомних мас Ar не є цілочисловими. Наприклад, у періодичній системі елемент Аргон із відносною атомною масою Ar ~ 39,95, яка перевищує відносну атомну масу Калію Ar (K) = 39,1, має атомний номер 18, а Калій — 19. Цей факт указує на те, що із суміші трьох ізотопів Аргону — IgAj** її Ar, JgAr, які існують у природі, масова частка ізотопу JgAr найбільша й становить 96,6 %. Ось чому середня величина масових чисел елемента Аргону — 39,95. Із природної суміші трьох ізотопів Калію JgK, JjJ K, ”К найбільша масова частка — 93,1 % припадає на ізотоп JgK. Тому середня величина відносної атомної маси Ar (K) = 39,1 визначається в основному масовим числом саме цього ізотопу. А з точки зору величини зарядів атомних ядер елементи Al' і K розташовані в періодичній системі правильно.
Радіоактиність. У 1903 році Е. Резерфорд і Ф. Содді дійшли висновку, що те радіоактивне випромінювання, яке 1896 року спостерігав А. Беккерель, виникає за умови розпаду радіоактивних елементів із перетворенням їх на атоми інших елементів. Наприклад, радіоактивний розпад Радію супроводжується утворенням нових елементів — Радону й Гелію:
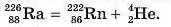
Спонтанне (самочинне) перетворення нестійких атомних ядер на інші ядра, що супроводжується випромінюванням різних частинок, називають радіоактивним розпадомхімічних елементів, або радіоактивністю.
Ізотоп Радію 2^Ra існує в природі, тому його радіоактивність називають природною радіоактивністю, а сам ізотоп 2^lRa — природним радіоактивним ізотопом.
Радіоактивні ізотопи одержують і штучно — за допомогою ядерних реакцій. У такому разі їх називають штучними. Усі вони є нестійкими ізотопами. Радіоактивні штучні ізотопи добуто для переважної більшості хімічних елементів. їх існує більше двох тисяч.
Елементи, які складаються тільки з радіоактивних ізотопів, називають радіоактивними, або радіонуклідами.Це елементи з порядковими номерами Z = 43, 61 і 84-110.
Радіоактивного розпаду зазнають ядра елементів, у яких порушено стійке співвідношення чисел протонів і нейтронів: для легких елементів A/Z ~ 2, а для важких може досягати 2,6.
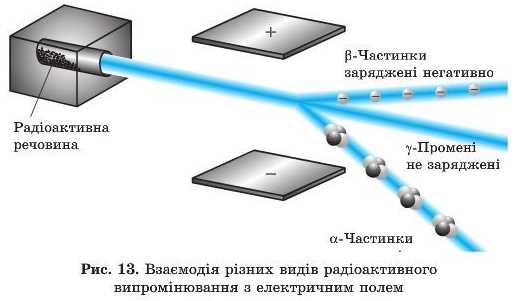
Дослідження надали можливості виділити три види радіоактивного випромінювання (рис. 13), кожному з яких відповідає свій тип радіоактивного перетворення.
Основні типи ядерних реакцій (перетворень):
• а -розпад, під час якого масове число атома зменшується на 4, а заряд ядра — на 2, наприклад (рис. 14, а):
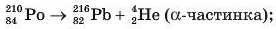
• р-розпад, під час якого масове число ізотопу не змінюється (оскільки загальне число протонів і нейтронів зберігається), а заряд ядра збільшується на 1 (рис. 14, б); буває трьох видів:
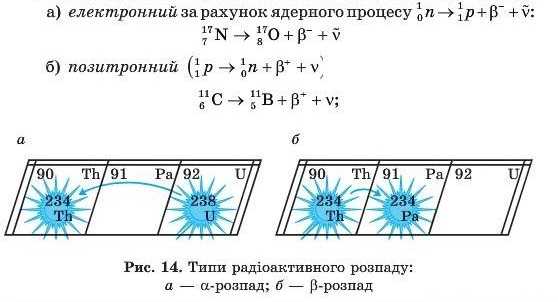
У наведених схемах р ip — частинки з масою електрона та зарядами, що відповідно дорівнюють — 1 і +1, V і v — нейтрино і антинейтрино — елементарні частинки, які не мають маси спокою та заряду й відрізняються одна від одної напрямком обертання навколо власної осі — за чи проти руху годинникової стрілки.
Ядерні реакції часто супроводжуються випромінюванням у-променів — квантів жорсткого електромагнітного випромінювання — під час спонтанного поділу ядер.
Тривалість життя (існування) радіоактивного елемента характеризують періодом напіврозпаду Tlt2 — терміном, за який число ядер зменшується в результаті розпаду удвоє. Значення Tli2 змінюється в дуже широких межах — від декількох тисячних секунди до мільярдів років. До елементів з великим періодом напіврозпаду належать Торій 232Th (T12 = 14'IO10 років), Уран 2l8U (Tlt2 = 4,5 • IO^ років), до елементів з малим періодом напіврозпаду — Полоній 218P (Tlt2 = 3,05 хв).
Стабільних (нерадіоактивних) ізотопів відомо близько 300. За хімічними властивостями радіоактивні ізотопи практично не відрізняються від стабільних.
Застосування радіоактивних ізотопів. Радіоактивні ізотопи широко використовують у наукових дослідженнях, промисловості, сільському господарстві, медицині, біології та хімії, тому їх одержують у великій кількості. За допомогою радіоізотопів досліджують хімічні реакції, вивчають шляхи поширення ліків у організмі, знищують клітини ракових пухлин, контролюють витік газу та нафти, визначають вік археологічних об’єктів, гірських порід. Вік Землі (близько 5 млрд років) було визначено за вмістом ізотопів Урану U

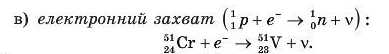
і Плюмбуму Pb в деяких гірських породах.
Шкідлива дія радіації на організми. У результаті дії радіації пошкоджуються клітини і порушується обмін речовин. Через це радіоактивне випромінювання дуже шкідливе для організму людини. Великі дози випромінювання призводять до серйозних захворювань і навіть загибелі. Тому спеціальними позначками вказують па місця, небезпечні через радіоактивне випромінювання (рис. 15).
• Для допитливих
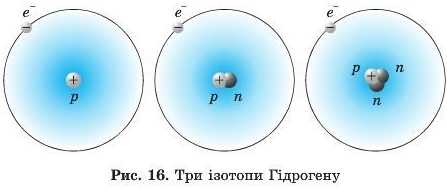
Ізотопи елемента Гідрогену, на відміну від ізотопів інших елементів, мають власні назви. Ізотопи Гідрогену позначають спеціальними символами. Звичайний Гідроген H(Jh) отримав назву Протій, важкий Гідроген D(Jh) — Дейтерій, а штучний надважкий T(JH) — Тритій. Ядра всіх ізотопів Гідрогену (рис. 16) містять один протон (Z = 1), ядро Дейтерію містить додатково один нейтрон (N = 1), а ядро Тритію — два нейтрони (N = 2).
Важка вода D2O, до складу якої входить Дейтерій, зовні подібна до звичайної води, але все ж таки має відмінності. Вона замерзає не за нульової температури, а за температури, меншої від 3,8 °С. Важкий лід, на відміну від звичайного, не плаває на поверхні води, а тоне.
До речі, який висновок про густину важкого льоду відносно важкої води можна зробити?
Запитання та завдання
1. Чому в періодичній системі елемент Кобальт, який має більше значення відносної атомної маси, стоїть перед елементом Нікелем з меншою атомною масою? Чи не є це порушенням періодичного закону? Що треба взяти до уваги, щоб дати відповідь на це запитання?
2. Чому маси атомів природних елементів мають дробове значення відносної атомної маси, якщо маси протонів і нейтронів прийнято за 1?
3. Атоми всіх ізотопів елемента мають однакове число: а) протонів і нейтронів; б) протонів і електронів; в) нейтронів і електронів. Яке твердження правильне?
4. Дайте визначення ізотопу. Наведіть приклади.
5. Чому заряд ядра є головною характеристикою елемента?
6. Визначте число протонів і електронів в атомах ізотопів Магнію ^Mg, -Mg, “Mg та Купруму Cu, “Cu.
7 За періодичною системою хімічних елементів позначте ізотопи Бору, якщо їхні атоми містять 10 і 11 нуклонів.
8. Наведено такі далі про атоми елементів: Е, Е, JJЕ, JJЕ,
JjE. Виберіть два атоми, які є ізотопами одного елемента. Про який елемент ідеться? Визначте число протонів і нейтронів у ядрах цих ізотопів.
9. Літій має два ізотопи: JjLi і JLi. Уміст у земній корі першого ізотопу становить 92,7 %, другого — 7,3 %. Обчисліть відносну атомну масу Літію.
10. Обчисліть масові частки ізотопів Аргентуму, якщо відомо, що цей елемент поширений у природі у вигляді двох ізотопів з масовими числами 107 і 109. Відносну атомпу масу прийміть рівною 107,868.
11. Поясніть взаємозв’язки між поняттями «хімічний елемент», «ізотоп», «масове число».
12. Які ізотопи називають радіоактивними? Наведіть приклади та підготуйте доповідь про застосування одного з них.
13. Як називають самочинне перетворення нестійких атомних ядер в ядра інших хімічних елементів, що супроводжується випромінюванням різних частинок?
с;14. Що таке період напіврозпаду радіоактивного елемента?
15. Де застосовують радіоактивні ізотопи?
16. У чому полягає шкідлива дія радіації па організми? Яким знаком позначають радіаційну небезпеку?
Це матеріал з підручника Хімія 8 клас Бутенко
Автор: admin от 19-10-2016, 19:52, Переглядів: 3365