§ 16. Будова атома. Сучасне формулювання періодичного закону
У цьому параграфі ви дізнаєтеся:
• з яких основних частинок складається атом;
• з яких основних частинок складається ядро атома;
• у чому полягає фізичний зміст атомного номера елемента;
• яка характеристика атома визначає періодичну повторюваність властивостей елементів і їхніх сполук.
Будова атома. До 70-х років XIX ст. атом уважали неподільною, тобто найменшою, або елементарною, частинкою речовини. Такі уявлення панували в науці довгий час. Але було неясно, чим атоми одного виду відрізняються від атомів іншого виду.
У XIX ст. за єдину кількісну характеристику атома брали його масу. Саме па цій підставі Д. І. Менделєєв побудував періодичну систему хімічних елементів. Однак він не зміг, користуючись тільки цими даними, пояснити причину періодичної повторюваності властивостей елементів. Було незрозуміло, чому атоми з близькою масою, наприклад Алюміній і Силіцій, дуже відрізняються за своїми властивостями, а атоми з різними масами, наприклад Літій і Натрій, мають подібні властивості. Це означало, що для характеристики спроможності атомів утворювати різні хімічні сполуки однієї кількісної величини — маси — недостатньо. Тому необхідно було вивчати внутрішню природу атомів.
Відкриття у фізиці на межі XIX-XX ст. показали, що атом має складну будову.
У 1895 році німецький фізик В. Рентген, а паралельно з ним український фізик І. Пулюй відкрили вид випромінювання, названий пізніше рентгенівським.
У 1896 році французький фізик А. Беккерель виявив, що речовини, які містять Уран U, засвічують у темряві фотоплівку, зумовлюючи світіння (флуоресценцію) деяких речовин, тобто виявляють властивості, притаманні рентгенівському випромінюванню.
У 1898 році французькі вчені П. Кюрі та М. Склодовська-Kiopi дійшли висновку, що не тільки Уран, але й інші елементи, наприклад Полоній Po і більшою мірою Радій Ra, мають спроможність випромінювати, яку вони назвали радіоактивністю.
Англійський учений Е. Резерфорд у 1899-1903 роках установив, що радіоактивне випромінювання пов’язане зі спонтанним розпадом атомів деяких (радіоактивних) елементів. Це свідчило про те, що атом неподільний лише хімічно, фізично ж він поділяється на ще менші частинки. Такий висновок підтвердили подальші дослідження радіоактивного випромінювання. У магнітному або постійному електричному полі це випромінювання розщеплюється на три випромінювання. Одне з них, так зване р-випромінювання, являє собою потік електронів. Зі здобутих результатів випливало, що до складу атома входять електрони.
Електрон— це найлегша елементарна частинка атома. Електричний заряд електрона називають елементарним — він найменший з усіх зарядів і дорівнює -1. Усі відомі позитивні та негативні заряди є кратними заряду електрона, тому його абсолютну величину взято за одиницю виміру. Електрон позна-чають символом е. Маса спокою електрона (9,1 • 10 ' кг) у 1837 разів менша за масу найлегшого атома Гідрогену.
а-Частинки (а-випромінювання) поряд із р-частинками (p-випромінюванням) входили до складу радіоактивного випромінювання, але на відміну від них виявляли високу проникну спроможність. Пізніше з’ясували, що вони являють собою ядра атомів Гелію, тобто позитивно заряджені частинки з величиною елементарного заряду +2.

Марія Склодовська-Кюрі (1867-1934)
Фізик і хімік, професор Паризького університету. Одна з творців вчення про радіоактивність. Разом з П’єром Кюрі відкрила Полоній і Радій. Добула металічний радій (1910), дослідила його властивості та ввела термін «радіоактивність». Разом з А. Беккере-лем і 11. Кюрі удостоєна Нобелівської премії з фізики (1903). Лауреат Нобелівської премії з хімії (1911).
Е. Резерфорд досліджував проходження а-частинок через дуже тонкі пластинки із золота — завтовшки всього 10 000 атомів.
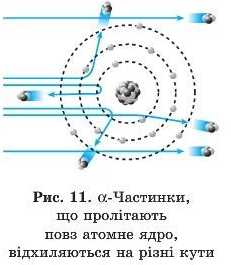
Учений установив, що більшість а-частинок завдяки великій проникній спроможності продовжують свій прямолінійний рух, але невелика частина з них змінювала напрямок руху й відхилялася на різні кути. І лише поодинокі а-частинки повністю відбивалися в протилежному напрямку від поверхні пластинки (рис. 11). Це явище назвали розсіюванням а-частииок.
На його підставі було зроблено висновок, що в центрі атома є надзвичайно мала щільна частинка, яка має позитивний заряд. Цю частинку назвали ядром атома (синонім — нуклід, від латинського писIeos, що означає «ядро»). У ньому зосереджена практично вся маса атома — 99,97 %.
На підставі цього відкриття Резерфорд у 1911 році створив планетарну модель атома, згідно з якою атом складається з позитивно зарядженого ядра й негативно заряджених електронів, що рухаються навколо нього (див. рис. 11).
З електропейтральності вільних (незв’язапих у молекули) атомів випливає, що в них мають міститися однакові кількості позитивних і негативних одиниць електрики. Весь позитивний
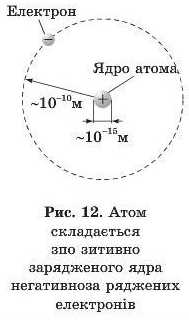
заряд зосереджено у ядрі атома. Він має компенсуватися відповідним числом негативно заряджених електронів, які групуються навколо ядра у вигляді так званих електронних оболонок (шарів), або енергетичних рівнів.
Розмір усього атома становить близько 10 10 м, а ядра — 10 15 м, тобто ядро приблизно в 100 000 разів менше від атома (рис. 12). Тому більшість а-частипок пролітала крізь атоми металічних пластинок на достатньо значних відстанях від їхніх ядер і не відхилялася від початкової траєкторії прямолінійного руху. Однак деякі а-частинки проходили поблизу ядра, у результаті чого позитивно заряджені ядра та а-частинки відштовхувалися і а-частинки відхилялися на якийсь кут. Ті а-частинки, які істотно наближалися до ядра, відштовхувалися ним і летіли у зворотному напрямку.
Сучасне формулювання періодичного закону. У 1913 році англійський учений Г. Мозлі в дослідах із рентгенівським випромінюванням визначив, що атоми одного й того самого елемента завжди мають однаковий заряд ядра, хоча маса їхніх атомів може бути різною. Приклад, який ми вже розглядали (див. § 4), — атоми Карбону. Це означає, що не маса, а саме заряд ядра є основною фізичною характеристикою, яка відрізняє атоми одного виду від атомів іншого. Завдяки цим дослідам стало також зрозумілим, що заряд ядра атома завжди чисельно дорівнює атомному (порядковому) номеру Z елемента в періодичній системі. Це дає можливість дати точніше визначення поняття «хімічний елемент».
Хімічний елемент — це вид атомів з однаковим зарядом ядра.
Через те що головною характеристикою хімічного елемента є не маса, а заряд ядра його атома, було змінено й формулювання періодичного закону, що мало відповідати новому фізичному змісту, пов’язаному з будовою атома.
Властивості хімічних елементів, а також утворених ними простих і складних речовин перебувають у періодичній залежності від зарядів атомних ядер.

Ернест Резерфорд
(1871-1937)
Під час дослідження розпаду радіоактивних елементів Е. Резерфорд відкрив а- й р-випромінювання та створив першу теорію радіоактивності. За ці відкриття в 1908 році йому було присуджено Нобелівську премію з хімії. Резерфорд також відкрив атомне ядро, запропонував планетарну модель атома і провів першу у світі штучну ядерну реакцію.
• Запитання та завдання
1. Чому Д. І. Менделєєв не зміг пояснити причину періодичної повторюваності властивостей елементів?
Із курсу фізики 7 класу вам відомо, що однойменні заряди відштовхуються, а різнойменні — притягуються. Взаємодію електричних зарядів розглянуто детальніше в подальшому курсі фізики.
2. Які відкриття у фізиці иа межі XIX і XX ст. показали, що атом має складну будову?
3. Яку властивість деяких елементів назвали радіоактивністю? Із чим вона пов’язана?
4. Яким чином науковці дійшли висновку, що до складу атома входять електрони?
5. Як позначають електрон? Який елементарний заряд електрона? Чи можна віднести електрон до елементарних частинок? Чому?
6. Що таке сх-частиики (а-випроміпюванпя)? До складу якого випромінювання вони входять? Який їхній елементарний заряд? Ядрами якого елемента вони є?
7. Чому а-частинки, що пролітали повз атомне ядро, відхилялися від свого первісного напрямку? Чи збігався знак заряду а-частинок зі знаком заряду ядер атома Ауруму? Який висновок із результатів цих дослідів зробив Е. Резерфорд? Як він назвав свою модель атома? Чому?
8. У чому полягала сутність результатів Г. Мозлі, одержаних у дослідах із рентгенівським випромінюванням?
3 9. Які частинки входять до складу атома? Який вони мають заряд?
10. Які характеристики атома ви знаєте?
11. Дайте визначення поняття «хімічний елемент».
12. Наведіть сучасне формулювання періодичного закону. Чим воно відрізняється від того, що ви вивчали раніше?
Це матеріал з підручника Хімія 8 клас Бутенко
Автор: admin от 19-10-2016, 19:51, Переглядів: 1568