§ 15. Періодична система хімічних елементів Д. І. Менделєєва
У цьому параграфі ви дізнаєтеся:
• які варіанти періодичної системи є найбільш розповсюдженими;
• яке число елементів відкрито на теперішній час;
• які характеристики кожного елемента наведено в періодичній системі;
• за якою ознакою елементи в періодичній системі поділяють на періоди та групи;
• які періоди називають малими, а які — великими;
• чому групи в короткій формі періодичної системи поділяють на головні і побічні.
Після відкриття періодичного закону Д. І. Менделєєв розпочав створення періодичної системи елементів, над удосконаленням якої працював усе своє подальше життя — близько 40 років.
На сьогодні відомо кілька сотень варіантів періодичної системи: у вигляді таблиць, геометричних фігур, аналітичних кривих тощо. Але найбільшого розповсюдження набули такі:
• коротка форма, або 8-кліткова, у створенні якої брав участь ще сам Д. І. Менделєєв;
• довга форма, або 18-кліткова.
Усі сучасні форми періодичної системи містять 112 зі 118 відкритих на теперішній час хімічних елементів. Кожний з них позначений тільки йому притаманним хімічним знаком і посідає певне місце — клітинку в таблиці відповідно до свого атомного, або порядкового, номера (Z). Тут наведено й такі його характеристики, як назва елемента та середня відносна атомна маса (Ar).
У таблиці короткої форми всі 112 елементів розбито на періоди (їх сім) і групи (їх вісім).
Період— це горизонтальний ряд елементів, розташованих у порядку зростання їхніх атомних номерів. Він починається лужним металічним елементом і закінчується інертним елементом (благородним газом).
Винятком є перший період, який починається неметалічпим елементом — Гідрогеном, і сьомий період — незакінчений.
Періоди поділяють на малі і великі.
Малі періоди — це 1, 2 і 3-й, які складаються лише з одного горизонтального ряду. У першому періоді містяться тільки два елементи (Гідроген і Гелій), у другому та третьому — по вісім елементів. За пропозицією Д. І. Менделєєва, їх назвали типовими.
Великі періоди — це 4, 5, 6 і 7-й, із них 4, 5 і 6-й складаються з двох горизонтальних рядів. При цьому верхній ряд є парним, а нижній — непарним. Четвертий і п’ятий періоди містять по 18 елементів, шостий — 32. Сьомий період, хоча він і складається з одного ряду, відносять до великих, у розрахунку на те, що його буде поповнено новими — відкритими або синтезованими елементами. Усього в періодичній системі налічують десять рядів.
У шостому періоді після елемента Лантану La (атомний номер 57) розташовані 14 елементів з атомними номерами 58-71, об’єднані загальною назвою «лантаноїди», тобто подібні за хімічними властивостями до Лантану. У сьомому періоді після Актинію Ac (атомний номер 89) розташовані 14 елементів, атомні номери яких 90-103. їх об’єднано загальною назвою «актиноїди», тобто подібні за хімічними властивостями до Актинію. Через це для лантаноїдів і актиноїдів у шостому
й сьомому періодах виділено всього по одній клітинці, позначених відповідно символами La і Ас.
Хімічні знаки лантаноїдів та актиноїдів, а також їхні атомні номери й відносні атомні маси поміщено в клітинках під періодичною системою елементів.
Група — це вертикальний ряд, який містить елементи з однаковою вищою валентністю, що дорівнює номеру групи.
Номер групи (римська цифра зверху таблиці) указує на максимально можливу валентність у сполуках, утворених елементами, які належать до даної групи. Так, атоми всіх елементів IV групи під час утворення певних сполук виявляють вищу валентність, що дорівнює чотирьом.
Кожна група складається з двох підгруп: головної і побічної.
Головні підгрупи — це підгрупи, які містять елементи малих і великих періодів. їх позначають буквою А.
У періодичній системі елементів короткої форми є вісім головних підгруп, тому що немає елементів, які виявляли б валентність, вищу за вісім.
До складі' головних підгруп можуть входити:
• металічні елементи — головні підгрупи I, II і III груп (виняток — Бор);
• неметалічиі елементи — головні підгрупи VI і VH груп;
• благородні гази — головна підгрупа VIH групи.
Побічні підгрупи — це підгрупи, до складу яких входять елементи тільки великих періодів. Починаються вони в четвертому періоді. їх позначають буквою Б.
Усі елементи побічних підгруп є металічними елементами. Як приклад поділу елементів на підгрупи молша розглянути II групу.
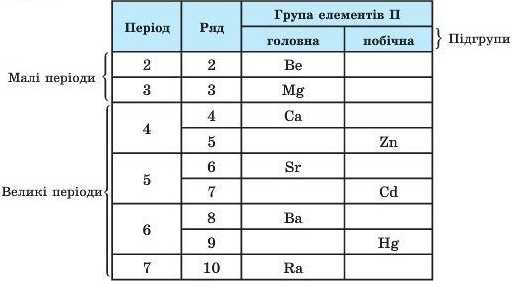
У головній підгрупі елементи — неметал Ічні, у побічній — металічні. Але за досить незначним винятком подібність елементів обох підгруп полягає в тому, що в сполуках вони спроможні виявляти найвищу валентність, яка дорівнює номеру групи. Тому їхні вищі оксиди (тобто ті, у яких елемент виявляє вищу валентність) мають загальну формулу E2O7 (у періодичній таблиці їх позначають як R2O7). Виняток — Флуор: його валентність не перевищує І.
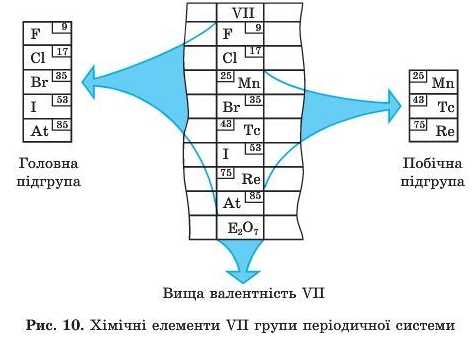
Елементи кожної підгрупи мають дуже подібні хімічні властивості. Водночас властивості елементів головних і побічних підгруп достатньою мірою відрізняються. Наприклад, у VII групі є дві підгрупи: головна — галогенів і побічна — Мангану (рис. 10).
• Запитання та завдання
0 1. Скільки варіантів періодичної системи хімічних елементів відомо на сьогодні? Які з них набули найбільшого застосування?
2. Скільки елементів відкрито па теперішній час?
° 3. Скільки періодів і груп у короткій формі періодичної системи?
с 4. Що таке період? Які періоди ви знаєте? Які періоди Д. І. Менделєєв назвав типовими?
5. Скільки елементів розташовано: а) у першому періоді?
б) у малих періодах? в) у четвертому періоді?
6. У якому періоді розташовані елементи-лантаиоїди? Чому їх виокремлено й розташовано внизу періодичної системи?
7. Що таке група? На підставі яких ознак елементи об’єднують в одну групу?
8. Укажіть, яку найвищу валентність спроможні виявляти в сполуках елементи: а) Сульфур; б) Манган; в) Силіцій.
* 9. Напишіть хімічний символ, атомний номер (Z) і середню
відносну атомну масу (А,.) елемента, який розташований:
а) у четвертому періоді та в побічній підгрупі III групи;
б) у третьому періоді та в головній підгрупі VII групи;
в) у п’ятому періоді та в головній підгрупі V групи.
* 10. Визначте найвищу валентність атомів елементів у сполу
ках, якщо їхні атомні (порядкові) номери такі: а) б, 15, 21; б) 4, 13, 25; в) 7, 12, 15;
г) 12, 16, 24; ґ) 5, 14, 23.
Це матеріал з підручника Хімія 8 клас Бутенко
Автор: admin от 19-10-2016, 19:51, Переглядів: 6128