§ 12. Розрахункові задачі: обчислення масової частки й маси розчиненої речовини в розчині
У цьому параграфі ви повторите:
• який спосіб вираження вмісту розчиненої речовини в розчині називають масовою часткою;
• як обчислювати масову частку й масу розчиненої речовини в розчині.
Склад будь-якого розчину можна виразити як якісно, так і кількісно. У разі якісної оцінки розчинів застосовують такі поняття, як розбавлений і концентрований розчин. Розчин із відносно низьким умістом розчиненої речовини називають розбавленим, а розчин із відносно високим умістом розчиненої речовини — концентрованим. Для більш точної кількісної оцінки розчинів використовують інше поняття: масову частку розчиненої речовини.
Масовою часткою розчиненої речовини (w) називають відношення маси розчиненої речовини до загальної маси розчину:
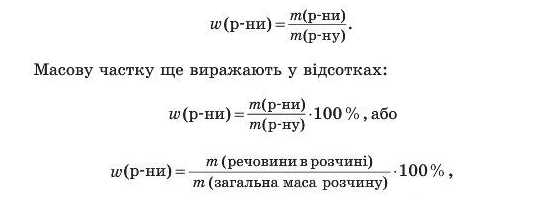
де т (розчину) = т (речовини) + т (розчинника).
Якщо замість маси розчину т(р-ну) наведено значення його об’єму V(p-iiy) та густини р(р-пу), то використовують іншу формулу:
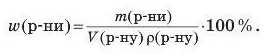
Таким чином, уміст розчиненої речовини в розчині виражають у частках одиниці або у відсотках.
Знання цих способів дуже важливе для практичного приготування розчинів і розв’язування задач.
• Приклади розв’язування задач
Приклад 1. У 180 г води розчинили 60 г цукру. Яка масова частка (%) розчиненого цукру в розчині?
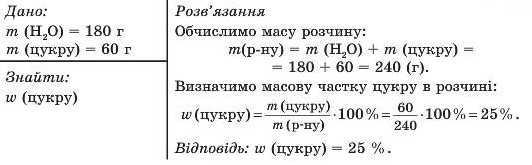
Приклад 2. Яку масу натрій хлориду та води потрібно взяти для приготування 460 г розчину з масовою часткою NaCl 15 %?

Приклад 3. Якою є масова частка (%) натрій гідроксиду у випареному розчині, якщо 300 г його розчину з масовою часткою NaOH 5 % випарили до 200 г?

Приклад 4. Яку масу 10 %-вого та яку масу 50 %-вого розчинів нітратної кислоти потрібно взяти, щоби приготувати 500 г 25 %-вого розчину?

Запитання та завдання
° 1. Що означає поняття «розбавлений розчин»? «концентрований розчин»? Чи можливо на його основі вказати точні значення концентрацій цих розчинів?
° 2. Яке поняття використовують для більш точної кількісної оцінки розчинів?
° 3. Сформулюйте визначення поняття «масова частка розчиненої речовини».
4. За якими формулами визначають масову частку розчиненої речовини? У яких одиницях, якщо відомі маси розчину й розчиненої речовини, її виражають?
5. За якою формулою визначають масову частку розчиненої речовини, якщо відомі об’єм розчину, його густина та маса розчиненої речовини?
6. Визначте масову частку (%) алюміній хлориду AlCl3 у розчині, одержаному змішуванням 200 г розчину AlCl3 з масовою часткою 8 % і 100 г розчину AlCl3 з масовою часткою 12 %.
7. Які маси кальцій нітрату Ca(NO3)2 і води потрібно взяти, щоб одержати 2 кг розчину з масовою часткою 10 %?
8. До 300 г води прилили 300 г розчину з масовою часткою нітратної кислоти ЗО %. Якою стала масова частка нітратної кислоти в отриманому розчині?
9. Які маси солі та води потрібно взяти для приготування 200 г розчинуз масовою часткою 25 %?
10. Яка масова частка (%) солі у випареному розчині, якщо 1800 г розчину солі з масовою часткою ЗО % випарили до 1200 г?
11. До 600 г розчину натрій хлориду з масовою часткою 24 % додали 360 г води. Яка масова частка (%) натрій хлориду в розчині після його розбавлення?
12. Порцію негашеного вапна CaO масою 16,8 г розчинили в 750 г води. Яка масова частка (%) Ca(OH)2 в утвореному розчині?
13. Яку масу розчину купрум(ІІ) сульфату з масовою часткою CuSO1 5 % можна приготувати, маючи 50 см3 води?
14. Яку масу солі треба додати до 300 г розчину солі з масовою часткою 15 %, щоб масова частка отриманого розчину дорівнювала 24 %?
15. Якою є масова частка сульфатної кислоти, якщо її розчин об’ємом 200 см3 і густиною 1,3 г/см3 містить 117,6 г H2SO1?
'16. Змішали два розчини натрій гідроксиду NaOH: 120 г з масовою часткою 5 % та 130 г з масовою часткою 15 %. Обчисліть масову частку натрій гідроксиду в отриманому розчині.
* 17. У посудину налили 50 г розчину солі з w = 2 %, потім додали ЗО г розчину солі з w = 4 % та 40 г розчину розчину тієї ж солі з W = 5 %. Розчин нагріли, у результаті чого випарилося 20 г води. Яка масова частка солі в отриманому розчині?
І Тестові завдання
Відповіді на завдання, наведені у вигляді тестів, нададуть вам можливості самостійно перевірити рівень засвоєння матеріалу попередніх параграфів.
1. Хімія вивчає:
а) властивості речовин;
б) властивості речовин та їхніх сумішей;
в) властивості речовин та їхні перетворення;
г) механізми хімічних реакцій.
2. Найдрібнішою хімічно неподільною частинкою речовини є:
а) молекула; б) йон; в) атом; г) хімічний елемент.
3. Знайдіть хибне твердження. До хімічних властивостей речовин відносять:
а) взаємодію з киснем;
б) електропровідність;
в) змінення кольору під час нагрівання;
г) горіння;
ґ) дію на індикатори.
4. Знайдіть хибне твердження. До фізичних властивостей речовин відносять:
а) агрегатний стан; б) розчинність у воді;
в) температуру плавлення; г) електропровідність; ґ) густину.
5. Про хімічний елемент можна сказати, що:
а) у ході хімічних реакцій елементи не зберігаються;
б) формою існування елемента є тільки проста речовина;
в) формою існування елемента є тільки складна речовина;
г) формою існування елемента є як проста, так і складна речовина.
6. Серед перелічених властивостей не характерною для хімічного елемента є:
а) абсолютна атомна маса;
б) агрегатний стан за звичайних умов;
в) хімічна активність;
г) валентність.
7. На підставі хімічної формули складної речовини неможливо визначити:
а) кількісний елементний склад;
б) якісний елементний склад;
в) хімічну будову речовини;
г) валентність елементів.
8. Масові співвідношення елементів у нітратній кислоті HNO3 дорівнює:
а) 2 : 14 : 64; б) 1 : 14 : 48; в) 1 : 28 : 60; г) 2 : 7 : 48.
9. Скільки хімічних елементів з наведеного переліку: Силіцій, Калій, Хлор, Магній, Сульфур, Ферум, Нітроген, Карбон — мають постійну валентність у сполуках?
а) 5; б) 9; ' в) 2; г) 6.
10. Нітроген має валентність III у всіх сполуках ряду:
а) NO2Cl, NOF, N2H1; в) NF3, NO, N2O.;
б) NH3, Li3N, N2O3; г) N2O, N2O1, NO2.
11. Масова частка Хлору має найбільше значення в сполуці:
a) Cl2O; б) ClO2; в) Cl2O7; г) ClO3.
12. Масова частка Натрію в сполуці Na2E дорівнює 36,8 %, тому другим елементом є:
а) Сульфур; б) Телур; в) Оксиген; г) Селен.
13. Масова частка Нітрогену найменша в сполуці:
a) (NH1)3PO1; б) Al(NO3)3; в) HNO3; г) NaNO2.
14. Оксид металічного елемента(ІІ) містить 40 % Оксигену за масою. Цим металічним елементом є:
а) Цинк; б) Манган; в) Ферум; г) Кальцій.
15. Найпростішою формулою речовини, у якій масові частки Нітрогену та Гідрогену дорівнюють відповідно 87,5 % і 12,5 %, є:
a) NH; б) NH2; в) NH3; г) NH1.
16. Найпростішою формулою речовини, у якій масові частки Карбону та Гідрогену дорівнюють відповідно 75 % і 25 %, є: "
a) CHi; б) CH3; в) CH2; г) СН.
17. Про закон збереження маси речовин можна сказати:
а) маса речовини зберігається, оскільки атоми не руйнуються;
б) із графіту масою 4 г можна одержати 4 г алмазів;
в) маса речовин, що вступили в реакцію, дорівнює масі речовин, які утворилися;
г) маса речовини залишається сталою.
Яке судження відповідає формулюванню цього закону?
18. У результаті випарювання 400 г розчину солі з масовою часткою 20 % зменшення його маси становило:
а) 120 г; б) 380 г; в) 80 г; г) 320 г.
19. У результаті розчинення порції цукру масою 20 г у воді об’ємом ЗО см3 отримали розчин із масовою часткою цу-кру:
а) 50 %; б) 40 %; в) ЗО %; г) 20 %.
20. Масова частка розчиненої речовини в розчині w (р-ни), маса розчиненої речовини та маса розчину зв’язані між собою формулою:
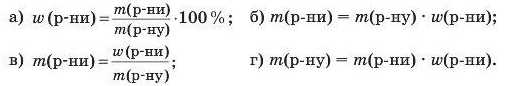
Найважливіше в розділі 1
• Хімія — це наука про склад, будову та властивості речовин і взаємні перетворення.
• Матеріальний світ складається з атомів. Атом — це хімічно неподільна частинка речовини. Атоми з однаковим зарядом ядра називають хімічним елементом. Прості речовини складаються з атомів одного виду, а складні — з атомів декількох видів.
• Молекула — найменша частинка речовини, яка має її хімічні властивості та складається з атомів, сполучених між собою хімічними зв’язками.
• Відносні маси атомів (Ar) і молекул (Mr) показують, у скільки разів маса даної частинки більша за 1/12 маси атома Карбону з атомною масою 12. Відносна молекулярна або фор-мульна маса сполуки дорівнює сумі відносних атомних мас хімічних елементів, що її утворюють, узятих з урахуванням числа атомів кожного з них.
• Якісний і кількісний склад речовини записують у вигляді хімічної формули, до якої входять символи хімічних елементів та індекси, що вказують на число атомів кожного елемента.
• Масове співвідношення елементів у сполуці — це відношення відносних атомних мас елементів, що входять до їхнього склада, з урахуванням індексів при хімічних символах цих елементів. На підставі масового співвідношення елементів у сполуці молша виводити формули дво- і триелементпих сполук.
• Масова частка (w) хімічного елемента (E) в речовині (X) показує, яка частина відносної молекулярної маси припадає на даний елемент:
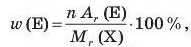
де п — індекс елемента в речовині.
Сума масових часток усіх хімічних елементів у сполуці дорівнює 1 (100 %).
• Масову частку розчиненої речовини в розчині визначають за формулою

якщо замість маси розчину тл(р-ну) наведено значення його об’єму Vr(P-Hy) та густини р(р-ну).
• Зміни, що відбуваються з речовинами та тілами, називають явищами. У разі фізичних явищ змінюється тільки форма тіла або агрегатний стан речовини, а склад речовини залишається незмінним. Хімічні явища, або хімічні реакції, супроводжуються перетворенням одних речовин на інші, які мають нові властивості.
• Про перебіг реакцій можна дізнатися за такими зовнішніми ефектами, як виділення або поглинання енергії, зміна забарвлення, утворення осаду, виділення газу, поява запаху. Речовини реагують між собою в певному масовому співвідношенні.
• У результаті хімічної реакції загальна маса речовин залишається незмінною (закон збереження маси речовин); умовно хімічні реакції записують у вигляді хімічних рівнянь.
• За хімічним складом і хімічними властивостями виділяють чотири найважливіших класи складних речовин: оксиди, гідроксиди, кислоти, солі. Для розпізнавання кислот і лугів (розчинних гідроксидів) застосовують речовини-іпдикатори.
Це матеріал з підручника Хімія 8 клас Бутенко
Автор: admin от 19-10-2016, 19:43, Переглядів: 35112