§ 10. Закон збереження маси речовини. Хімічні рівняння
У цьому параграфі ви повторите:
• у чому полягає сутність хімічної реакції;
• як записують перебіг хімічної реакції;
• що означають коефіцієнти в хімічному рівнянні.
Ha підставі численних експериментів російський учений Михайло Ломоносов (1748) і незалежно від нього французький хімік Антуан Лавуазье (1789) відкрили закон збереження маси речовини:
маса речовин, що вступають у хімічну реакцію, дорівнює масі речовин, які утворюються в результаті реакції.
На підтвердження цього висновку можна провести дуже простий дослід. Помістимо в колбу трохи ретельно змішаних між собою порошкоподібних алюмінію та сірки — суміш жовтого кольору з металічним блиском. Закриємо колбу пробкою та зважимо її. Потім обережно нагріємо колбу над газовим пальником (150-200 °С). Через деякий час можна спостерігати
появу білої порошкоподібної речовини — алюміній сульфіду AI2S3. Її утворення свідчить про перебіг хімічної реакції.
Повторне зважування колби після охолодження до кімнатної температури перекопує, що в результаті перебігу цієї реакції її маса з умістом залишилася незмінною, хоча початкові речовини вже перестали існувати внаслідок перетворення на складну речовину.
Такі перетворення в хімії заведено записувати у вигляді рівнянь хімічних реакцій: у лівій частині записують формули вихідних речовин (реагентів реакції), а в правій — формули кінцевих речовин (продуктів реакції):
Al + S -> Al2S3
Подібну форму запису називають схемою реакції.Щоб вона перетворилася на рівняння, потрібно зрівняти число атомів кожного хімічного елемента в лівій і правій частинах схеми (тобто до і після стрілки). Для цього розставляють стехіометричні (зрівнювальні) коефіцієнти, або просто коефіцієнти — цифри перед формулами речовин, які вказують на число частинок, що вступили в реакцію.
Неважко помітити, що число атомів Алюмінію та Сульфуру в лівій і правій частинах схеми різне: зліва один атом Алюмінію й один атом Сульфуру, справа — два атоми Алюмінію та три атоми Сульфуру. А це суперечить закону збереження маси речовини. Щоб позбавитися цього, перед формулою Алюмінію ставимо коефіцієнт 2, а перед формулою Сульфуру — коефіцієнт 3:
2А1 + 3S —» Al2S3
Через те що число атомів кожного виду в лівій і правій частинах схеми однакове за рахунок розставлених коефіцієнтів, стрілку між формулами реагентів і продуктів у схемі хімічної реакції можна замінити на знак рівності:
2А1 + 3S = Al2S3
Коефіцієнт 1, подібно до індексу 1 у формулі речовини, не ставлять. Після того як розставлено коефіцієнти, схема реакції перетворюється на хімічне рівняння — умовний запис хімічної реакції за допомогою хімічних знаків і формул.
Кожна формула відповідає одній структурній частинці речовини, а коефіцієнт показує число молекул у випадку речовин молекулярної будови або число формульиих одиниць — у випадку речовин немолекулярної будови. Кількості структурних частинок, що вступають у реакцію та утворюються внаслідок її перебігу, пропорційні коефіцієнтам перед формулами речовин.
Як приклад розглянемо реакцію взаємодії бору з йодом, яку можна подати таким рівнянням:
2В + ЗІ2 = 2 BI3
Із нього видно, що подібне пропорційне співвідношення існує і між масами речовин:
т (В) : т (I2) : т (BI3) =
= (2 • 11) г : 3 • (2 • 127) г : 2 • (11 + 3 • 127) г =
22 г : 762 г : 784 г.
Тому, якщо відома маса однієї з речовин (реагенту чи продукту) із цього співвідношення можна знайти невідомі маси інших речовин.
Наприклад, у реакцію вступило 44 г бору. Тоді можна визначити:
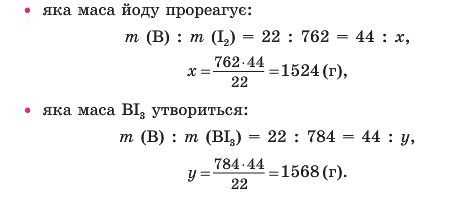
Рівняння реакції складають на підставі закону збереження маси речовин, відповідно до якого в лівій і правій частинах хімічного рівняння має бути однакове число атомів кожного елемента. Щоб скласти наприклад, рівняння реакції
P + O2 -> P2O5,
діють таким чином:
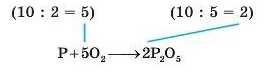
• спочатку зрівнюють число атомів, яких у реагуючих речовинах міститься більше. У нашому прикладі це число атомів Оксигену. Для цього визначають найменше спільне кратне чисел атомів Оксигену в лівій і правій частинах схеми реакції (у нашому випадку HCK дорівнює десяти);
• ділять найменше спільне кратне па відповідне число атомів Оксигену в лівій і правій частинах схеми та визначають коефіцієнти:
• зрівнюють число атомів інших хімічних елементів, у даному випадку число атомів Фосфору, яке справа дорівнює чотирьом, а зліва — лише одному:
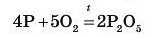
Якщо в результаті реакції між речовинами, узятими у твердому стані, утворюється газувата речовина, поруч з її формулою ставлять стрілку вверх Т. Якщо ж в результаті реакції між розчинами реагуючих речовин утворюється речовина, яка випадає в осад, то поруч із формулою цієї речовини ставлять стрілку вниз і.
Для того щоб почалася реакція, у багатьох випадках необхідно попередньо нагріти суміш реагуючих речовин. Тоді в рівняннях хімічних реакцій над знаком рівності ставлять знак t.
Ш Запитання та тестові завдання
0 1. Як формулюють закон збереження маси речовини?
0 2. Які вчені причетні до відкриття закону збереження маси речовини?
° 3. Яку форму запису хімічної реакції називають: а) схемою реакції; б) рівнянням реакції?
° 4. Що таке стехіометричні коефіцієнти в рівнянні реакції? На що вони вказують і як їх розставляють?
5. Який закон лежить в основі складання рівнянь хімічних реакцій?
6. Розставте коефіцієнти в схемах таких реакцій:
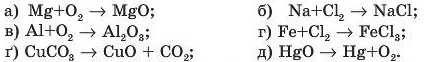
7. Укажіть рівняння хімічної реакції з найбільшою сумою всіх стехіометричних коефіцієнтів серед тих, які подано схемами:

8. Укажіть рівняння хімічної реакції з найменшою сумою всіх стехіометричних коефіцієнтів серед тих, які подано схемами:

9. Укажіть рівняння хімічної реакції, у якому стехіометричний коефіцієнт перед неметалічиим елементом є найменшим, якщо взаємодію речовин записано такими схемами:
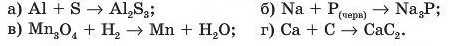
10. Визначте рівняння хімічної реакції, унаслідок перебігу якої маса води відповідно до стехіометричних коефіцієнтів є найбільшою, якщо реакції передано такими схемами:
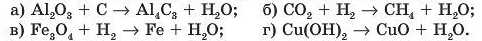
11. Визначте рівняння хімічної реакції, унаслідок перебігу якої маса SO2 відповідно до стехіометричних коефіцієнтів є найбільшою, якщо реакції записано такими схемами:
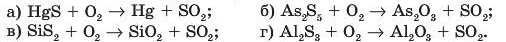
12. Визначте відповідність між стехіометричними коефіцієнтами перед формулою оксиду ExOy і формулою хлоридної кислоти в рівняннях хімічних реакцій, поданих у вигляді таких схем перетворень:
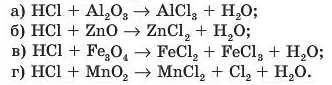
Це матеріал з підручника Хімія 8 клас Бутенко
Автор: admin от 19-10-2016, 19:42, Переглядів: 4631