§ 6. Валентність елементів
У цьому параграфі ви повторите:
• що таке валентність хімічного елемента;
• атоми яких елементів виявляють постійну валентність;
• яку валентність завжди виявляють атоми Гідрогену й Оксигену;
• як визначати валентність елементів за формулами сполук та складати формули за валентністю елементів.
Сполучення атомів між собою відбувається відповідно до їхньої валентності.
Валентність — це спроможність атомів одного елемента утворювати певне число хімічних зв’язків з атомами інших елементів.
Хімічні зв’язки між атомами заведено позначати рисочками. Слово «валентність» походить від латинського слова valenlia, що означає «сила, спроможність».
Для позначення валентності використовують римські цифри, які ставлять у формулі над символом хімічного елемента:

Деякі хімічні елементи виявляють у сполуках постійну валентність. Таких елементів не дуже багато, і тому їх досить легко запам’ятати (табл. 3).
Таблиця З
Хімічні елементи з постійною валентністю, розташовані в перших чотирьох періодах періодичної системи Д. І. Менделєєва
|
Значення валентності |
Хімічні елементи |
|
І |
Н, Li, Na, К, F |
|
II |
0, Be, Mg, Ca, Zn |
|
Ш |
Al, В, Sc, Ga |
Значення валентності можна знайти, наприклад, за номером групи, у якій розміщується елемент у періодичній системі: так, елементи LA, IIA та IIIA груп мають постійну валентність, що дорівнює відповідно номеру групи: валентність Натрію — І, Барію — II, Галію — III.
Але більшість елементів має змінне значення валентності. Її найвище значення часто збігається з номером групи періодичної системи, у якій цей елемент розміщується. Значення змінної валентності елемента в сполуках заведено вказувати в дужках після його назви. Наприклад, елемент головної підгрупи
IV групи (або інакше IVA групи) Карбон утворює такі оксиди: CO — карбон(ІІ) оксид і CO2 — Kap6on(IV) оксид, у якому він виявляє найвищу валентність JV.
Сполуки, що складаються з атомів двох хімічних елементів, називають бінарними.
Знання валентності елементів дає можливість, по-перше, визначати валентність елементів за формулами їхніх бінарних сполук; по-друге, складати хімічні формули бінарних сполук. Наприклад, ми знаємо формулу речовини, що складається з атомів двох хімічних елементів, а також валентність одного з них. Розглянемо, як можна визначити валентність другого елемента в бінарній сполуці.
Послідовність дій із визначення валентності елемента за формулою речовини
|
I |
Записуємо хімічну формулу бінарної сполуки та позначаємо відому валентність одного з елементів (табл. 3) |
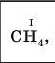 |
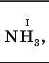 |
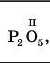 |
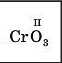 |
|
2 |
Множимо число атомів цього елемента на його валентність |
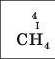 |
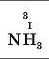 |
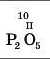 |
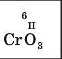 |
|
3 |
Ділимо отримане значення добутку на індекс, що показує число атомів другого елемента; записуємо одержане значення валентності над символом цього елемента |
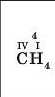 |
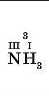 |
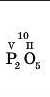 |
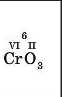 |
Тепер розглянемо, як можна визначати хімічні формули складних речовин за валентністю елементів, що входять до їхнього складу, па прикладі хлор(УП) оксиду та фосфор(У) фториду.
Послідовність дій під час складання хімічної формули речовини
за валентністю елементів
|
1 |
Записуємо символи хімічних елементів (на першому місці символи елемента, валентність якого указано в назві сполуки, на другому — символи елемента, валентність якого наведено в табл. 3) і знаходимо найменше спільне кратне (HCK) двох значень валентності |
 |
 |
|
2 |
Визначаємо індекси діленням HCK на валентність даного елемента та записуємо їх після символів кожного 3 хімічних елементів сполуки |
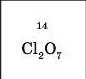 |
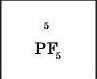 |
Слід пам'ятати: значения валентності може змінюватися від І до VIII, не може бути від'ємним, а також не може дорівнювати
rv п
нулю. Це справедливо як для складних речовин, наприклад CO2,
і
так і для простих, наприклад Cl2.
Найвища валентність деяких елементів не завжди збігається з номером групи періодичної системи, у якій стоїть цей елемент. Так, Нітроген, Оксигеп і Флуор розміщуються відповідно в п’ятій, шостій і сьомій групах, а їхня найвища валентність становить IV, II та І відповідно.
•і Запитання та завдання ° 1. Що розуміють під поняттям «валентність»?
2. Назвіть елементи, які в сполуках виявляють валентність, що дорівнює: а) І; б) II; в) III.
3. Визначте валентність атома: а) Сульфуру в сполуці H2S; б) Фосфору в сполуці P2O5; в) Бору в сполуці B2O3.
4. Укажіть валентність елементів у таких сполуках: V2O5, CuO, Cu2O, SO2, SF6, As2O5, Mg3P2, NO, N2O5, N2O, PbO, PbO2.
5. Наведіть приклади сполук елементів з Оксигепом, у яких ці елементи мають валентність: а) II, IV, VI; б) I, III, V.
1 6. Складіть формули речовин за валентностями елементів (якщо валентність не вказано над символом елемента, то вона постійна (табл. 3)):
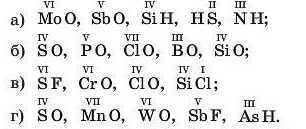
7. У сполуках SCl1, AsCl3, SbCl5, SnCl1 атом Хлору одновалентний. Визначте валентність атома другого елемента. Складіть формули сполук з Оксигепом, у яких валентність атомів цих елементів така сама, як і в сполуках з атомом Хлору.
Для допитливих З точки зору атомно-молекулярного вчення, валентність — це спроможність атома будь-якого елемента приєднувати або заміщувати певне число атомів іншого елемента. За одиницю валентності взято валент-
ність атома Гідрогену. Валентність атома Оксигену дорівнює двом. Наприклад, у сполуках HCl, H2O, NH3, CH1 атоми Хлору, Оксигепу, Нітрогену та Карбону спроможні приєднувати відповідно один, два, три та чотири атоми Гідрогену. Таким чином, у цих сполуках атом Хлору одновалентний, атом Оксигену — двовалентний, атом Нітрогену — тривалентний, атом Карбону — чотиривалентний. У реакції
2 HI + S = H2S + I2
один атом Сульфуру заміщує у двох молекулах гідроген йодиду НІ два атоми Йоду. Отже, Сульфур у даному випадку виявляє себе як двовалентний елемент.
Це матеріал з підручника Хімія 8 клас Бутенко
Автор: admin от 19-10-2016, 19:40, Переглядів: 5453