§ 31. Хімічні властивості солей
Опрацювавши зміст параграфа, ви будете:
• знати хімічні властивості солей;
• уміти складати рівняння хімічних реакцій, що ілюструють хімічні властивості солей.
Почнемо з лабораторних дослідів.
Дослід 1. У дві пробірки налийте по 1 мл розчину купрум(ІІ) сульфату CuSO l й обережно (по стінці пробірки) опустіть в одну пробірку гранулу цинку, а в іншу - очищений від іржі залізний цвях. Що спостерігається? Чому? Який висновок можна зробити?
Висновок. Солі реагують з металами:
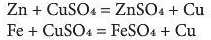
Але зверніть увагу: солі реагують не з усіма металами, а лише з тими, які в ряду активності металів {див. § 27) розміщені ліворуч від того металу який входить до складу солі. Наприклад, така реакція, як
Ag + Cu(N03>2 * не відбудеться (чому?)
Відбуваються тільки такі реакції, під час яких активніший метал витискує менш активний метал з розчину його солі, внаслідок чого утворюється нова сіль і новий метал.
Пам'ятай! Для взаємодії солей з металами не можна брати дуже активні метали, наприклад Li,Na, К, Ca, оскільки вони взаємодіють з водою за стандартних умов, а реакція солей з металами відбувається у водному розчині.
Дослід 2. Візьміть дві пробірки. У першу налийте трохи розчину ферум(III) хлориду і додайте трохи розчину натрій гідроксиду, а в другу - трохи розчину натрій сульфату і додайте розчину барій гідроксиду. Що спостерігається у пробірках? Що це засвідчує? Зробіть висновок.
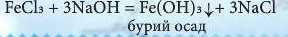

Висновок. Солі реагують з розчинними основами - лугами. Реакція відбувається лише у водному розчині. Це означає, що для реакції треба брата не сухі кристалічні солі, а тільки їх водні розчини. При цьому у водних розчинах речовини обмінюються своїми складовими, внаслідок чого утворюються нова сіль і нова основа.
Пам’ятай! Речовини, що реагують, треба добирати так, аби в результаті реакції одна з новоутворених речовин (основа або сіль) випадала в осад.
Дослід 3. В одну пробірку помістіть (обережно!) шматочок мармуру СаСОз, а в іншу - розчин натрій карбонату Na2CO3 (1 мл). В обидві пробірки додайте трохи розбавленої хлоридної кислоти НС1. Що спостерігається? Зробіть висновок.
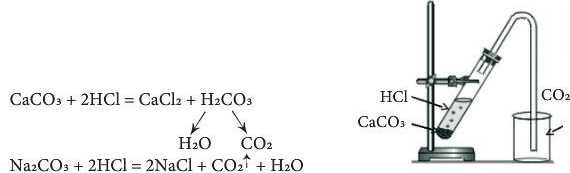
Висновок. Солі реагують з кислотами. Для реакції можна брати як суху сіль, так і її водний розчин. Відбувається реакція обміну, внаслідок якої утворюються нова сіль і нова кислота. Оскільки карбонатна кислота Н2СО3 дуже нестійка, вона відразу розкладається на відповідний їй оксид - вуглекислий газ і воду.
Пам’ятай! Реакція між сіллю і кислотою відбуватиметься лише тоді, коли:
• утворюється осад (нова сіль), не розчинний у кислотах:
AgNO3 + HCl = AgCli+ HNO3;
• кислота, що реагує, сильніша від тієї, якою утворена сіль:
Ca3(POt)2 + 3H2S04 = 3CaSO-.i+ 2НзРОі;
• сіль утворена леткою кислотою, а реагуюча кислота нелетка:
2NaNQ3 + H2SO-I = Na2SOi + 2HNQ3.
Дослід 4. У дві пробірки налий потрохи розчин}' натрій карбонату (0,5 мл). В одну з пробірок додай стільки ж розчину барій нітрату, а в іншу - цинк хлориду. Що спостерігається? Чому? Зроби висновок.
Зверніть увагу на умови, за яких ці реакції відбуваються (див. таблицю розчинності на форзаці підручника).
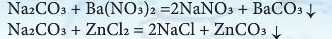
Висновок. Солі взаємодіють з солями. У водному розчині відбувається реакція обміну, внаслідок якої утворюються дві нові солі.
Пам’ятай! Реакція між двома солями відбуватиметься тільки тоді, коли обидві солі взято в розчині, а одна з новоутворених солей випадатиме в осад.
Висновки
Солі мають спільні хімічні властивості. За певних умов вони можуть взаємодіяти з металами, лугами, кислотами і між собою.
Завдання для самоконтролю
1. Які хімічні властивості характерні для солей? Відповідь ілюструйте рівняннями реакцій.
2. З якими із зазначених речовин реагуватиме ферум(ІІ) хлорид: а) мідь; 6) кальцій карбонат; в) натрій гідроксид; г) арґентум нітрат; д) купрум(ІІ) гідроксид; е) цинк. Напишіть рівняння можливих реакцій.
3. Під час взаємодії заліза масою 7 г із розчином купрум(ІІ) сульфату можна добути мідь масою:
A ^ 2г; Б 4 г; В 8 г; Г 16 г.
4. Унаслідок нейтралізації нітратною кислотою калій гідроксиду кількістю речовини 2 моль утворюється калій нітрат масою:
А 202 г; Б 20,2 г В 101г Г 10 г
5. Напишіть рівняння реакцій, за допомоги яких можна здійснити такі перетворення, і зазначте тип кожної реакції:
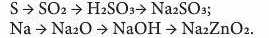
Додаткові завдання
6*. Як здійснити перетворення:
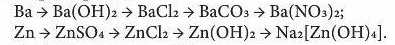
Напишіть відповідні рівняння реакцій.
7*. Як трьома різними способами добути: а) купрум(ІІ) хлорид; 6) магній ортофосфат. Напишіть відповідні рівняння реакцій.
8*. Залізну пластинку масою 50 г занурено в розчин купрум(ІІ) сульфату. Коли пластинка вкрилася міддю, її маса збільшилася на 1,5 г. Обчисліть масу заліза, що перейшло в розчин, і масу міді, яка осіла на пластинці.
Практична робота 1
Дослідження властивостей основних класів неорганічних сполук
На цьому занятті вам треба застосувати набуті знання для дослідження деяких властивостей оксидів, кислот, основ, солей. Це дасть змог)' переконатися в значенні експериментального методу для вивчення властивостей речовин. Виконуйте тільки ті два - три завдання, які призначить вам учитель. На закінчення складіть звіт про виконану роботу, наведіть короткі пояснення до дослідів та напишіть хімічні рівняння всіх виконаних реакцій, зазначивши їх тип, умови проведення і назви вихідних і добутих речовин.
Завдання 1.Вам видано два метали - магній у вигляді порошку і мідь у вигляді дротинки (або пластинки). Добудьте з них оксиди цих металів, використовуючи їхню властивість сполучатися з киснем повітря. Зазначте колір утворених оксидів.
Завдання 2.Користуючись виданими реактивами, добудьте ку-прум(ІІ) гідроксид і доведіть, що ця речовина є основою.
Завдання 3.Доведіть кислотні властивості сульфатної кислоти. Завдання 4.Здійсніть взаємодію купрум(ІІ) оксид)' з хлоридною кислотою. Які властивості купрум(ІІ) оксиду характеризують це перетворення?
Завдання 5.Здійсніть реакцію нейтралізації сульфатної кислоти розчином натрій гідроксиду. Який реактив ще необхідний, аби довести, що реакція відбулась і розчин у пробірці - нейтральний? Завдання 6.Як, використовуючи вапняну воду (розчин Са(ОН)2> можна довести, що вуглекислий газ, який ми видихаємо, є кислотним оксидом?
Завдання 7.Порівняйте відношення до нагрівання лугів і нерозчинних основ.
Завдання 8.Порівняйте відношення до кислот розчинних і нерозчинних основ.
Завдання 9.Дослідіть, чи можуть дві різні солі вступати одна з одною в реакцію обміну, зазначте умови, необхідні для такої взаємодії. Завдання 10.Дослідіть хімічні властивості:
а) хлоридної кислоти; в) сульфатної кислоти;
б) кальцій гідроксиду; г) натрій гідроксиду.
Це матеріал з підручника Хімія 8 клас Буринська
Автор: admin от 18-10-2016, 22:26, Переглядів: 2725