§ 19. Кількість речовини. Моль — одиниця кількості речовини

Опрацювавши матеріал параграфа, ви будете:
• розуміти зміст понять: кількість речовини, моль, число Авогадро;
• уміти здійснювати розрахунки з використанням зазначених понять.
Відомо, що для вивчення навколишнього світу недостатньо лише спостерігати й описувати об’єкти. Важливо ще характеризувати їх кількісно, тобто якимись величинами. Так, порцію води можна характеризувати кількісно, вимірявши її об’єм у літрах або масу в грамах. Але для хіміка важливо знати число структурних часток (атомів, молекул або йонів), які містяться в цій порції речовини, оскільки саме вони вступатимуть у хімічну взаємодію. Тому в хімії і суміжних з нею науках використовують фізичну величину - кількість речовини.
Кількість речовини - фізична величина, ще
визначається числом структурних часток (атомів
MOHeKJTI, йонів тощо), які містяться в певній пор-···
ції речовини
Вона позначається латинською літерою п (єн) (або грецькою V (ню), оскільки літерою п (єн) позначається також число атомів).
За одиницю кількості речовини прийнято моль.
Моль - така кількість речовини, яка містить стільки часток (атомів, молекул, йонів та ін.), скільки міститься атомів у Карбоні-12 масою 0,012 кг (12 г).
Отже, маса 1 моль вуглецю дорівнює 12 г. А скільки у цій порції вуглецю кількістю речовини 1 моль міститься атомів Карбону?
Експериментально доведено, що 1 моль речовини містить 6,02 · IO23 (скорочено 6 · IO23) часток (атомів, молекул, йонів та ін.). Це число на честь італійського вченого називається числом Авогадро.
Зазвичай число Авогадро позначають латинською літерою N з індексом А, тобто Na ·

Число Авогадро 6,02 · IO23 показує число часток, що містяться в 1 моль будь-якої речовини незалежно від її агрегатного стану.
Отже, 6,02 · IO23 - це число Авогадро, а фізико-хіміч-на константа, що відповідає цьому числу, називається сталою Авогадро і позначається також Na.
Якщо 1 моль речовини містить 6,02 · 1023 часток, то:
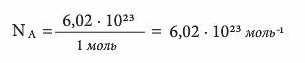
Це настільки велике число, що через силу піддається уяві. Проте спробуємо показати всю його грандіозність. Воно більше за число склянок води у Світовому океані. Якби ми спромоглися виміряти всю воду Світового океану склянками, то дістали 6 майже 7 · 1014 склянок. Хоча це число саме по собі величезне, але воно становить лише одну мільярдну частину сталої Авогадро!
Інший приклад. Число макових зерняток, що дорівнює 6 · IO23, має масу IO13 т. Цією ліасою макових зерняток можна було 6 вкрити всю поверхню Землі шаром в 1 м.
Отже, 1 моль будь-якої речовини містить Na часток, тобто 6 · K)23. Наприклад, 1 моль міді - це 6 · IO23 атомів Купруму Cu; 1 моль кисню - це 6 · IO23 молекул Ог або 12 · H)23 атомів Оксигену; 1 моль кухонної солі NaCl -6 · IO23 формульних одиниць NaCL
Розглянемо приклади розрахунків із використанням сталої Авогадро.
Приклад 1. Яке число молекул містить вуглекислий газ CCh кількістю речовини 4 моль?
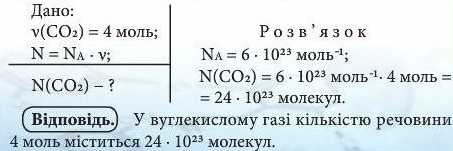

Висновки
Кількість речовини - це фізична величина, що визначається числом структурних частинок, які містяться в певній порції речовини.
Моль - це одиниця кількості речовини.
Один моль будь-якої речовини містить 6,02 · IO23 структурних часток (молекул, формульних одиниць, атомів, йонів).
Завдання для самоконтролю
1. Скільки атомів Гідрогену й Оксигену міститься у воді Н2О кількістю речовини 1 моль (виконати усно)?
2. Скільки атомів містить: а) мідь кількістю речовини 3 моль; 6) залізо кількістю речовини 0,5 моль?
3. Скільки молекул і атомів містить азот N2 кількістю речовини 2 моль?
4. Яку кількість речовини становить: а) 3 · IO23 атомів Сульфуру;
6) 18 · IO23 молекул брому Bn?
Додаткові завдання 5*. Заповни таблицю:
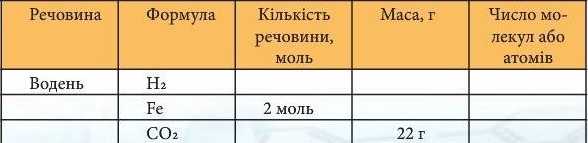
6*. Число атомів Оксигену в озоні Оз масою 48 г становить (а) 6 · IO23; (6) 3 · 1023; (в) 12 · IO23; (г) 18 · IO23.
Це матеріал з підручника Хімія 8 клас Буринська
Автор: admin от 18-10-2016, 22:17, Переглядів: 2437