§ 38. Применение электролиза
Существует легенда, что в конце XVIII в. король Англии прислал в подарок российской императрице Екатерине II... алюминиевую кружку. Сейчас это сложно представить, но императрица была поражена таким ценным подарком! Дело в том, что в те времена алюминий был редким металлом и стоил намного дороже золота. Со временем благодаря применению электролиза алюминий стал общедоступным. О том, как с помощью электролиза получают металлы и где еще применяют электролиз, пойдет речь в этом параграфе.

Применяем электролиз для получения металлов
Электролиз широко используют в промышленности. С помощью электролиза из солей и оксидов получают многие металлы: медь, никель, алюминий и др. Например, чтобы получить алюминий, в качестве электролита используют алюминий оксид (Al2Oj, растворенный в расплавленном криолите (Na8AlF6) при температуре 950 °С. Раствор помещают в специальные электролитические ванны; катодом обычно служат дно и стенки ванны, выложенные графитом, а анодом — погруженные в электролит угольные блоки. При прохождении тока через электролит на катоде выделяется алюминий (рис. 38.1).
Получаем чистые металлы
Металлы, полученные в результате электролиза (или иным способом), обычно содержат некоторое количество примесей, поскольку сырье не может быть «идеальным». Так, в расплаве всегда имеются соли и оксиды других металлов, которые тоже могут выделиться на катоде. Для очистки металлов от примесей можно снова использовать электролиз.
Способ очистки металлов с помощью электролиза называют рафинированием.
Таким способом очищают медь, алюминий, свинец, серебро и некоторые другие металлы. В качестве примера рассмотрим очищение меди.
В ванну с раствором купрум (II) сульфата (CuSOj опускают два электрода. Анодом служит толстая пластинка неочищенной меди, а катодом — тонкая пластинка чистой меди (рис. 38.2).
В растворе купрум (II) сульфат распадается на ионы Купрума (Cu2+) и ионы сульфата (SOj). Ионы Купрума движутся к катоду и оседают на нем. Ионы сульфата движутся к аноду и «забирают» у него ионы Купрума. Вновь образовавшийся купрум (II) сульфат попадает в раствор, и там распадается. В итоге чистая медь переносится с анода на катод. Анод при этом растворяется, а примеси оседают на дне или остаются в растворе.
Знакомимся с гальваностегией
С помощью электролиза можно нанести тонкий слой металла на поверхность изделия — сделать серебрение, золочение, никелирование, хромирование и т. д. Такой слой может защищать от коррозии, увеличивать прочность изделия или просто быть его украшением.
Электролитический способ покрытия изделия тонким слоем металла называют гальваностегией.
Изделие, которое хотят покрыть слоем какого-либо металла, опускают в ванну с раствором электролита, в состав которого входит данный металл. Изделие служит катодом, а пластинка металла, которым покрывают изделие, — анодом. Во время прохождения тока металл оседает на изделии (катоде), а анодная пластинка постепенно растворяется (рис. 38.3).
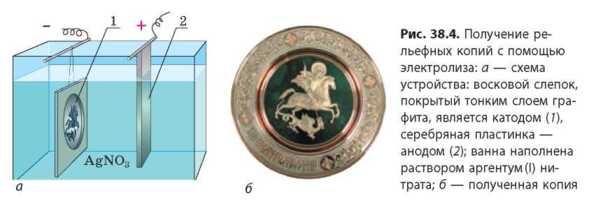
Изучаем гальванопластику
Гальванопластика — это получение с помощью электролиза точных копий рельефных изделий.
Сначала из воска или другого пластичного материала делают слепок рельефного изделия. Чтобы поверхность слепка проводила ток, ее покрывают тонким слоем графита. Затем слепок помещают в ванну с раствором электролита. Слепок будет служить катодом, а пластинка металла — анодом. Во время электролиза на слепке образуется довольно толстый слой металла, который заполняет все неровности слепка. После прекращения электролиза восковой слепок отделяют от слоя металла и в результате получают точную копию изделия (рис. 38.4).
Понятно, что применение электролиза в современной технике не ограничено рассмотренными примерами. С помощью электролиза можно осуществить полировку поверхности анода; электролиз лежит в основе зарядки и разрядки кислотных и щелочных аккумуляторов и др.

15 Учимся решать задачи
Задача. При никелировании на каждый 1 дм2 поверхности никелируемого изделия подают силу тока 0,4 А. За какое время на изделие будет нанесен слой никеля толщиной 0,02 мм?
Анализ физической проблемы. Время протекания электролиза вычислим, воспользовавшись первым законом Фарадея; массу вещества, выделившегося на катоде, выразим через плотность и объем слоя никеля. Электрохимический эквивалент и плотность никеля найдем соответственно в табл. 8 и 9 Приложения. Решая задачу, плотность удобно представить в граммах на кубический сантиметр, а следовательно, толщину слоя — в сантиметрах, площадь поверхности — в квадратных сантиметрах, электрохимический эквивалент — в граммах на кулон.

Подводим итоги
Электролиз широко применяют в промышленности. C помощью элек тролиза из солей и оксидов получают многие металлы (медь, никель алюминий и др.), а также очищают их. Способ очистки металлов с помо щью электролиза называют рафинированием.
С помощью электролиза можно нанести тонкий слой металла на поверхность изделия (осуществить серебрение, золочение, никелирование, хромирование и т. д.), изготовить точные копии рельефных изделий. Электролитический способ покрытия изделия тонким слоем металла называют гальваностегией, а получение с помощью электролиза точных копий рельефных изделий — гальванопластикой.
Контрольные вопросы —
1. Приведите примеры применения электролиза. 2. Опишите процесс получения алюминия с помощью электролиза. 3. Как можно очистить металлы от примесей? 4. Для чего поверхность металлов покрывают тонким слоем другого металла? 5. Что такое гальваностегия? гальванопластика?
Упражнение № 38
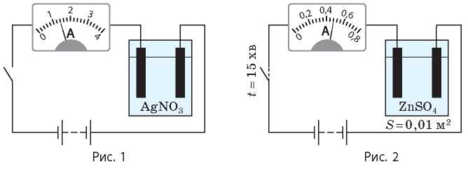
1. На рис. 1 приведено схематическое изображение электрической цепи.
1) Назовите основные элементы цепи.
2) Какой электрод служит катодом, а какой — анодом?
3) На каком электроде оседает серебро?
4) Какова сила тока в цепи?
5) За какое время на электроде образуется слой серебра массой 2,52 г?
6) Какая энергия будет израсходована при серебрении, если напряжение на электродах равно 11 В?
2. На рис. 2 приведено схематическое изображение электрической цепи, в состав которой входит сосуд с водным раствором цинк (II) сульфата. По данным рисунка вычислите толщину слоя цинка, который образуется на катоде в результате электролиза.
3. Для серебрения ложек через раствор аргентум (I) нитрата пропускали ток силой 1,8 А. Катодом служили 12 ложек, каждая из которых имела площадь поверхности 50 см2. Сколько времени длился электролиз, если на ложках образовался слой серебра толщиной 58 мкм?
4. При рафинировании меди анодом служит пластина неочищенной меди массой 2 кг, содержащая 12 % примесей. Сколько энергии необходимо затратить для очистки этой меди, если процесс протекает при напряжении 6 В?
5. Какие из приведенных веществ и материалов являются проводниками, а какие — диэлектриками: 1) дистиллированная вода; 2) медь; 3) воздух; 4) морская вода; 5) золото; 6) ртуть; 7) резина; 8) фарфор?
Автор: admin от 26-09-2016, 21:04, Переглядів: 2603