§ 37. Электрический ток в электролитах
Дистиллированная вода — диэлектрик, поскольку в ней почти нет свободных заряженных частиц; диэлектриком является и поваренная соль. Но если крупинку поваренной соли бросить в дистиллированную воду, то полученный раствор хорошо будет проводить ток. Почему это так? Откуда в растворе взялись свободные частицы, имеющие электрический заряд?
Знакомимся с электролитами
Многие кристаллические вещества представляют собой положительные и отрицательные ионы, соединенные в одно целое силой электрического притяжения. Так, кристаллы натрий хлорида — поваренной соли (Nad) — состоят из положительных ионов Натрия (Na+) и отрицательных ионов Хлора (Cl ) (рис. 37.1), кристаллы купрум (II) сульфата (CuSO4) — из положительных ионов Купрума (Cu2+) и отрицательных ионов сульфата (SO42). Если такие вещества растворить в воде, они могут распасться на отдельные ионы.
Процесс распада веществ на ионы рассмотрим на примере распада поваренной соли (NaCl) в воде (H2O). Как вы уже знаете из курса химии, молекулы воды являются полярными: атомы Гидрогена и атом Оксигена в молекуле воды расположены несимметрично, поэтому с одной стороны молекулы доминирует положительный заряд, а с другой стороны — такой же отрицательный (рис. 37.2, а). Следовательно, молекулу воды можно представить как электрический диполь15 (рис. 37.2, б).
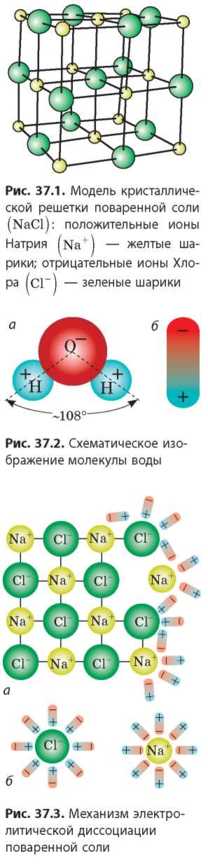
Когда кристаллик соли попадает в воду, диполи воды окружают ионы Натрия и ионы Хлора, ориентируясь определенным образом (рис. 37.3, а). Некоторые диполи воды попадают в промежутки между ионами и значительно ослабляют силу их притяжения. В результате данного процесса и вследствие теплового движения молекул воды ионы отделяются от кристаллика (рис. 37.3, б).
Распад веществ на ионы в результате действия полярных молекул растворителя называют электролитической диссоциацией (от латин. dissociatio — разъединение, разделение).
В результате электролитической диссоциации в растворе появляются свободные заряженные частицы — положительные и отрицательные ионы, поэтому раствор начинает проводить ток.
Опыты показывают, что распад веществ на ионы может быть вызван не только растворителем. Некоторые соли и оксиды металлов могут распадаться на ионы в результате значительного увеличения температуры. Поэтому расплавы этих веществ тоже проводят электрический ток. Растворы и расплавы веществ, проводящие электрический ток, относят к электролитам.
Исследуем природу электрического тока в электролитах
Возьмем два угольных электрода и соединим их с полюсами источника тока (см. рис. 37.4). Электрод, соединенный с положительным полюсом источника тока, называют анодом, а электрод, соединенный с отрицательным полюсом, — катодом. Опустим электроды в сосуд с электролитом, например, с водным раствором купрум (II) хлорида (Cud2), и замкнем цепь. В растворе возникнет электрическое поле, из-за действия которого свободные положительные ионы Купрума (Cu2+) направятся к катоду, а свободные отрицательные ионы Хлора (Cl ) — к аноду (рис. 37.4). Таким образом в растворе возникнет направленное движение свободных заряженных частиц — электрический ток.
Электрический ток в электролитах представляет собой направленное движение положительных и отрицательных ионов.
Ионный механизм проводимости имеют не только некоторые растворы и расплавы, но и некоторые твердые вещества, например аргентум (I) йодид (AgI), калий йодид (KI), аргентум (I) сульфид (Ag2S). В твердых веществах с ионной проводимостью перемещаются ионы только одного знака — или только положительные, или только отрицательные.
Электролиты — это твердые или жидкие вещества, обладающие ионной проводимостью.
Заметим, что с увеличением температуры количество свободных ионов в электролитах увеличивается, соответственно увеличивается и сила тока. Это означает, что с увеличением температуры сопротивление электролитов уменьшается.
Даём определение электролиза
При прохождении тока через электролит (в отличие от прохождения тока через металл) происходит перенос химических составляющих электролита и те выделяются на электродах — оседают в виде твердого слоя или выделяются в газообразном состоянии. Например, если через водный раствор купрум (II) хлорида в течение нескольких минут пропускать ток, то поверхность катода покроет тонкий слой меди (рис. 37.5), а на аноде выделится газообразный хлор. Наличие хлора можно обнаружить по характерному запаху.
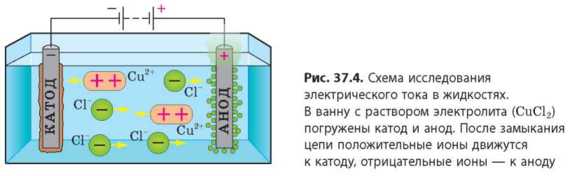
Объясним, почему так происходит. При прохождении тока свободные положительные ионы Купрума (Cu2+) движутся к катоду, а свободные отрицательные ионы Хлора (Cl) — к аноду (см. рис. 37.4). Достигнув катода, положительные ионы Купрума «берут» с его поверхности электроны, которых им «не хватает», то есть происходит химическая реакция восстановления. В результате этой реакции ионы Купрума превращаются в нейтральные атомы; на поверхности катода оседает медь. В то же время орицательные ионы Хлора, достигнув поверхности анода, наоборот, «отдают» ему «избыточные» электроны — происходит химическая реакция окисления; на аноде выделяется хлор.

Процесс выделения веществ на электродах, который связан с окислительно-восстановительными реакциями, происходящими на электродах при прохождении тока, называют електролизом.
Открываем закон Фарадея
Впервые явление электролиза подробно изучил английский физик М. Фарадей (рис. 37.6). Он сформулировал закон, который позже был назван законом електролиза, или первым законом Фарадея:
Масса вещества, выделяющегося на электроде, прямо пропорциональна заряду, прошедшему через электролит:
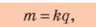
где m — масса вещества; k — коэффициент пропорциональности, который называют электрохимическим эквивалентом; q — значение электрического заряда.
Электрохимический эквивалент численно равен массе данного вещества, выделяющегося на электроде в результате прохождения через электролит заряда 1 Кл.
Единица электрохимического эквивалента в СИ — килограмм на кулон: 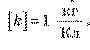
Электрохимические эквиваленты в миллионы раз меньше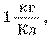 поэтому в таблицах (см. табл. 8 Приложения) их чаще выражают в миллиграммах на кулон:
поэтому в таблицах (см. табл. 8 Приложения) их чаще выражают в миллиграммах на кулон: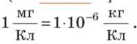 Так, электрохимический эквивалент
Так, электрохимический эквивалент
серебра I Ag+j равен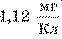 , а электрохимический эквивалент алюминия
, а электрохимический эквивалент алюминия
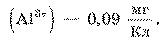
Обратите внимание: первый закон электролиза можно записать также в виде: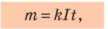
где m — масса вещества; k — электрохимический эквивалент; I — сила тока в электролите; t — время, в течение которого длился электролиз.
Докажите идентичность формул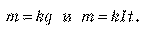
Учимся решать задачи
Задача. Для определения электрохимического эквивалента меди через раствор купрум (II) сульфата в течение 30 мин пропускали ток силой 0,5 А. Какое значение электрохимического эквивалента получили, если масса катода до начала опыта была 75,20 г, а после опыта — 75,47 г?
Анализ физической проблемы. Для решения задачи воспользуемся законом электролиза. Массу меди, выделившейся на катоде, найдем как разность масс катода после опыта и до него. Электрохимические эквиваленты чаще подают в миллиграммах на кулон, поэтому массы катода выразим в миллиграммах.

Подводим итоги
Электролиты — это твердые и жидкие вещества, обладающие ионной проводимостью. Распад электролитов на ионы вследствие действия полярных молекул растворителя называют электролитической диссоциацией. В результате диссоциации в растворе появляются свободные заряженные частицы — положительные и отрицательные ионы.
Электрический ток в электролитах — это направленное движение положительных и отрицательных ионов.
При прохождении электрического тока через электролит химические составляющие электролита оседают на электродах или выделяются в газообразном состоянии — происходит электролиз. Электролиз — это процесс выделения веществ на электродах, связанный с окислительно-восстановительными реакциями, происходящими на электродах при прохождении тока.
Для электролиза выполняется первый закон Фарадея (закон электролиза): масса m вещества, выделяющегося на электроде, прямо пропорциональна заряду q, который прошел через электролит: m = kq, или m = kit. Коэффициент пропорциональности k называют электрохимическим эквивалентом.
Контрольные вопросы —
I. В чем заключается явление электролитической диссоциации? Приведите примеры. 2. Что такое электролит? 3. Что представляет собой
электрический ток в электролитах? 4. Опишите процесс электролиза.
5. Сформулируйте первый закон Фарадея. 6. Каков физический смысл
электрохимического эквивалента?
Упражнение № 37
1. Воспользовавшись законом электролиза, выведите единицу электрохимического эквивалента в СИ.
2. Дистиллированная вода не является проводником. А почему водопроводная, речная и морская вода проводит электрический ток?
3. Почему раствор соли в воде хорошо проводит электрический ток, а раствор сахара в воде — плохо?
4. Во время электролиза, где электролитом был раствор аргентум (I) нитрата, на катоде выделилось 25 г серебра. Сколько времени длился электролиз, если сила тока была неизменной и составляла 0,5 А?
5. Во время электролиза, где электролитом был раствор сульфатной кислоты, за 50 мин выделилось 3 г водорода. Определите потери мощности на нагревание электролита, если его сопротивление 0,4 Ом.
6. Сын кузнеца и ученик переплетчика Майкл Фарадей смог стать выдающимся ученым. Воспользуйтесь дополнительными источниками информации и узнайте о жизни М. Фарадея и истории его открытий.
. 7. При серебрении стальной ложки на ее поверхность был нанесен тонкий слой серебра толщиной 55 мкм. Определите массу серебра, если площадь поверхности ложки равна 40 см2.
Автор: admin от 26-09-2016, 21:04, Переглядів: 2437