§ 27. Вивчаємо кислоти, їхні фізичні й хімічні властивості
— Слова «кислота» й «кислий» недарма мають спільний корінь. Розчини майже всіх кислот на смак кислі. Це не означає, що розчин будь-якої кислоти можна пробувати на сматг — серед них трапляються дуже їдкі й навіть отруйні!
— Але такі кислоти, як етанова (міститься в столовому оцті), аскорбінова (вітамін С), яблучна, лимонна, щавлева (ці кислоти містяться в рослинах), знайомі нам саме своїм кислим смаком.
З розчином нашатирного спирту досліди слід проводити па кухні з відкритим вікном або працюючою витяжкою.
СКЛАД І НАЗВИ КИСЛОТ
Кислоти — складні речовини, до складу яких входять атоми Гідрогену й кислотний залишок.
Склад і будову, назви кислот ми вже розглядали. Якщо ви забули, повторіть § 18.
Гідроген, який входить до складу кислот, не тільки бере участь у формуванні кислого смаку речовин, але й обумовлює багато їхніх хімічних властивостей. Так, він легко може заміщатися на атоми металів, при цьому утворюються солі. Тому назви солей походять від назв кислот (табл. 12).
Назви кислот і утворених ними солей*
Таблиця 12
|
Назва кислоти |
Хімічна формула кислоти |
1 'і Jl |
Сумарний ступінь окиснення кислотного залишку |
Назва солі |
Приклад хімічної формули солі |
|
Нітратна |
 |
 |
-1 |
Нітрати |
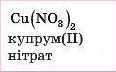 |
|
Нітритна |
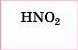 |
 |
-1 |
Нітрити |
 |
|
Сульфатна |
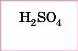 |
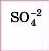 |
-2 |
Сульфати |
 |
|
Сульфітна |
 |
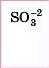 |
-2 |
Сульфіти |
 |
|
Сульфідна |
 |
 |
-2 |
Сульфіди |
 |
* Зверніть увагу, що у верхній частині таблиці наведено оксигеповмісні кислоти й солі, утворені оксигеповмісішми кислотними залишками, у нижній безоксигенові кислоти й солі, утворені безоксигеповими кислотними залишками.
|
„ Хімічна Назва формула кислоти кислоти |
Кислотний залишок |
Сумарний ступінь Приклад окиснення Назва солі хімічної кислотного формули солі залишку |
|||
|
Карбонатна |
 |
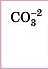 |
-2 |
Карбонати |
 |
|
Силікатна |
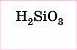 |
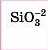 |
-2 |
Силікати |
 |
|
Ортофос- фатна |
 |
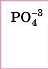 |
-3 |
Оротофос- фати |
 |
|
Бромідна |
 |
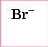 |
-1 |
Броміди |
 |
|
Йодидна |
 |
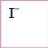 |
-1 |
Йодиди |
 |
|
Хлоридна |
 |
 |
-1 |
Хлориди |
 |
|
Флуоридна |
 |
 |
-1 |
Флуориди |
 |
Ступінь окиснення — це властивість атомів елементів, тому застосування його до кислотного залишку досить умовне. Зверніть увагу, що ступінь окиснення кислотного залишку дорівнює сумі ступенів окиснення всіх атомів, що входять у нього.
— Згадайте, ми вивчали, що ступінь окиснення кислотного залишку дорівнює числу атомів Гідрогену в молекулі кислоти: два Гідрогени — ступінь окиснення кислотного залишку — два, три Гідрогени — три, ну, а один Гідроген — і ступінь окиснення теж один. Подивіться таблицю!
Деякі кислоти мають історично сформовані, так звані тривіальні назви. Наприклад, сульфатну кислоту називають іще сірчаною, хлоридну — соляною, флуоридну — плавиковою, нітратну — азотною, сульфідну — сірководневою, карбонатну — вугільною, а силікатну — кремнієвою.
ФІЗИЧНІ ВЛАСТИВОСТІ кислот
Частина неорганічних кислот — безбарвні рідини.
Ортофосфатна кислота — тверда речовина білого кольору, добре розчинна у воді.
Силікатна кислота — теж тверда біла речовина. Вона у воді не розчиняється.
Є й інші кислоти у твердому агрегатному стані, наприклад бо-ратиа. Вона погано розчиняється навіть у гарячій воді {рис. 62).

Всі атоми в молекулах кислот зв’язані ковалентними зв’язками, тому для них характерні властивості речовин із молекулярною кристалічною ґраткою, наприклад низькі температури плавлення.
Деякі кислоти (наприклад, HCl, HBr, HF, H2S та інші) леткі, тобто їхні молекули «вилітають» із розчину. Є кислоти, які не виділені в чистому вигляді. Вони існують тільки в розчинах. Це, наприклад, карбонатна H2CO3 і сульфітна H2SO3 кислоти.
Кислоти, які добре розчиняються у воді й активно (швидко, бурхливо) вступають у хімічні реакції, називають сильними кислотами.
Погано розчинні кислоти або кислоти, які легко розкладаються на оксид і воду, деякі леткі кислоти — слабкі.
Є й кислоти середньої сили.
У зв’язку із цим існує ще одна класифікація кислот — за силою
(табл. 13).
Таблиця 13
Сильні та слабкі кислоти
|
Сильні кислоти |
Кислоти середньої сили |
Слабкі кислоти |
|
НІ йодидна HBr бромідна HClхлоридна H2SO1 сульфатна HNO3 нітратна |
HF флуоридна H3PO1 ортофосфатна |
H2SO3 сульфітна H2S сульфідна H2CO3 карбонатна H2SiO3 силікатна |
ПРАВИЛА РОБОТИ З КИСЛОТАМИ
Увага! Кислоти — дуже небезпечні речовини.
Всі сильні кислоти — сульфатна, нітратна, хлоридна й навіть не дуже сильні, такі як, наприклад, етанова кислота, можуть спричинити сильні опіки, руйнувати тканини. Тому під час роботи з кислотами необхідно дотримуватися запобіжних заходів. Якщо кислота потрапила на одяг або на поверхню тіла, то її необхідно дуже швидко змити великою кількістю проточної води (до зникнення відчуття печіння) або нейтралізувати розчином амоніаку (нашатирним спиртом). А якщо кислота потрапила на дерев’яну, металічну або на інші поверхні, то її нейтралізують вапном, крейдою або содою.
Кислоти необхідно зберігати в добре закритому' посуді в не доступному для дітей місці, на пляшці (упаковці) обов’язково повинна бути бірка з назвою кислоти.
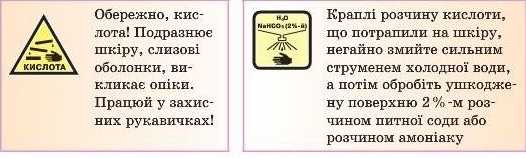
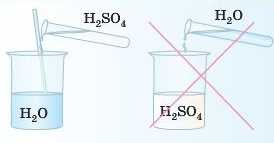
Сульфатна кислота — одна з найсильніших кислот. Концентрована кислота обвуглює цукор, дерево, бавовну, вовну й викликає дуже глибокі опіки шкіри.
Увага! Під час приготування розчину сульфатної кислоти необхідно діяти за таким правилом: кислоту ллють у воду тонким струмком по скляній паличці, але не навпаки.
ХІМІЧНІ ВЛАСТИВОСТІ кислот
Розглянемо найважливіші хімічні властивості кислот.
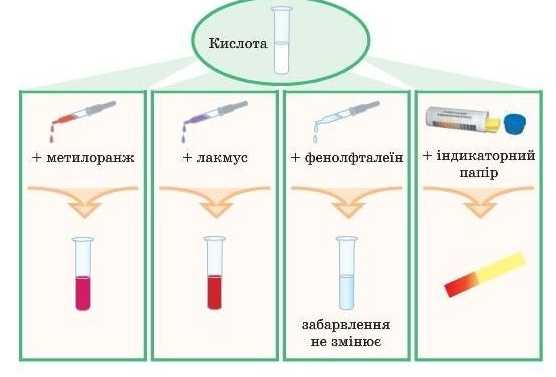
1. Дія розчинів кислот на індикатори
Що таке індикатори і яким буває середовище, ми вже вивчали в § 13.
Згадаємо, що в усіх розчинів кислот середовище кисле, тому що в цих розчинах є йони H+.
У кислому середовищі індикатори лакмус, метиловий оранжевий, універсальний індикаторний папір змінюють своє забарвлення на червоне.
— Виявляється, можна легко визначити кислий розчин чи ні, не пробуючи його на смак?!
— Звичайно! Справжні хіміки так і роблять — тестують розчин індикатором
— А вдома можна це зробити?
— Так. Читай нашу «Домашню лабораторію#.
— Цю взаємодію ми вивчали в темі «Основи#. Я знаю, як правильно написати це \ рівняння реакції, тому мені вчити менше!
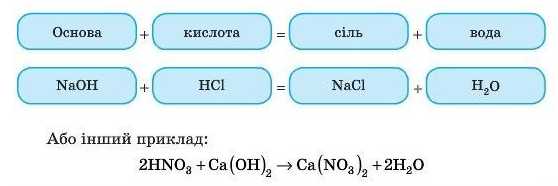
2. Взаємодія кислот з основами
Цю реакцію, як ви вже знаєте, називають реакцією нейтралізації.
Кислота реагує з основою з утворенням солі, в якій завжди в незмінному вигляді міститься кислотний залишок. Другим продуктом реакції нейтралізації обов’язково є вода.
Це реакції обміну.
Наприклад:
Кислотні залишки в реакціях обміну переходять без змін з однієї сполуки (кислоти) в іншу (сіль).
Реакція нейтралізації нам трапляється й у медицині. Наприклад, у разі захворювань шлунка з підвищеною кислотністю (а в шлунку міститься хлоридна кислота) хворі приймають ліки, які містять магній гідроксид, що нейтралізує надлишок кислоти. Місце укусу ос, мурах, опіку кропиви потрібно протерти розчином нашатирного спирту (це луг), і відчуття печіння вмить зникне: мурашина кислота, яка викликала печіння, нейтралізована.
Завдання
Спробуйте самі закінчити рівняння реакцій. Для перевірки дивіться відповідь 1 наприкінці параграфа.
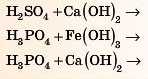
3. Взаємодія кислот з оксидами металів
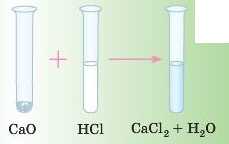
Дослід
Якщо долити до білого порошку CaO розчин хлорид ної кислоти, осад відразу розчиниться, і ми одержимо прозорий розчин.
Як і у випадку реакцій з основами, з оксидами металів (основними та амфотерними) кислоти утворюють сіль і воду. Це реакція обміну.
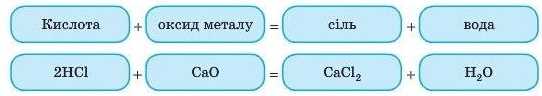
Завдання
— Цю реакцію ми вже вивчали в темі «Оксиди». Я її знаю, і мені вчити менше!
Спробуйте самі закінчити рівняння реакцій. Для перевірки дивіться відповідь 2 наприкінці параграфа.

Фосфатну кислоту використовують для очищення заліза від іржі (оксидів і гідроксидів Феруму). Вона входить до складу засобу «Перетворювач іржі». Фосфатна кислота, розчиняючи на поверхні металу його сполуки, із самим залізом реагує дуже повільно. Оксиди й гідроксиди Феруму перетворюються на нерозчинну сіль FePO4, яка осаджується на поверхні металу й утворює міцну плівку.
Чому не можна зберігати кислі розчини в алюмінієвій каструлі?
4. Взаємодія кислот із металами
Для взаємодії кислот із металом мають бути дотримані деякі умови.
По-перше, метал повинен бути досить активним (реакційно-здатним) щодо кислот. Неактивні метали — золото, срібло, ртуть і деякі інші метали — з кислотами не реагують. Такі метали, як магній, залізо, цинк, навпаки, реагують дуже активно з виділенням газоподібного водню й великої кількості тепла.
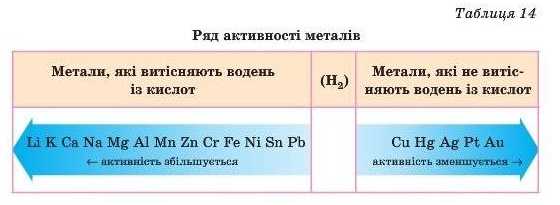
Щоби визначити активність металу, треба звернутися до таблиці «Ряд активності металів» (табл. 14).
Чим лівіше розташований метал у ряді активності металів, тим він активніший.
1859 р. російський учений, один з основоположників фізичної хімії Микола Миколайович Бекетов (1827-1911) зробив у Парижі повідомлення на тему «Дослідження над явищами витіснення одних елементів іншими». 1865 року вийшла його книга з описом цих досліджень, яку було надрукована в Харкові російською мовою. У цій роботі Бекетов узагальнив дослідження щодо здатності одних металів витісняти інші з розчинів їх солей. Звідси назва — «Ви-тискувальний ряд», або «Ряд активності».
З часом накопичувалося дедалі більше свідчень того, що деякі «правила витіснення» можуть порушуватися. Так, ви самі можете бачити, що літій у ряді стоїть першим, але ж його хімічна активність значно менше, ніж у натрію або калію. Причини цього складні, і ми не будемо їх зараз розглядати.
Схожі ряди метачів пропонували й інші вчені. Наприклад, задовго до робіт М. Бекетова Алессандро Вольта дослідним шляхом визначив «ряд напруг» метачів: Zn, Pb, Sn, Fe, Cu, Ag, Au.
Теоретичну основу ряду активності (і ряду напруг) метачів заклав німецький фізико-хімік Вальтер Нернст (1864-1941), який дав йому назву «Ряд стандартних електродних потєнціачів».
Метали, які стоять у ряді активності металів до водню, витісняють водень із розведених кислот (крім нітратної кислоти).
Якщо ви добре запам’ятаєте це правило, воно обов’язково допоможе вам під час складання рівнянь.
По-друге, кислота має бути досить реакційноздатиою (сильною), щоби реагувати навіть із мачоактивним металом.
Кислоти рослин (яблучна, лимонна, щавлева тощо) є слабкими кислотами й дуже повільно реагують із такими металами, як цинк, хром, залізо, нікель, олово, свинець (хоча з основами й оксидами металів вони здатні реагувати швидше).
Розчини таких сильних кислот, як сульфатна або хлоридна, здатні реагувати з усіма металами з лівої частини «Ряду активності металів».
Реакція взаємодії кислот і металів належить до реакцій заміщення: атоми металу заміщують атоми Гідрогену' в кислоті. Крім водню, ще утворюються солі. Цю реакцію часто використовують для одержання водню.
Реакції, між простими і складними речовинами, в результаті яких атоми простої речовини заміщують атоми одного з елементів складної речовини, називають реакціями заміщення. У результаті цих реакцій утворюється проста і складна речовини.

Дослід
Проведемо експеримент: помістимо в пробірку гранули цинку (або сталь — сплав на основі заліза (наприклад, скріпку, цвях)) і додамо розчин кислоти — сульфатної, хлоридної, можна етанової. Спостерігаємо виділення бульбашок газу. Це виділяється водень.
J D 1
Zn HCl ZnCl2 + H2
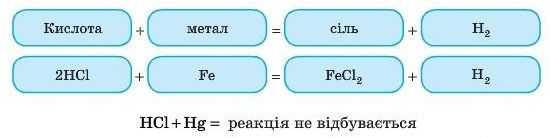
— Тут знову метал стає замість Гідрогену!
А кислотний залишок не змінюється! І ще: треба перевіряти, чи правильно складено формулу солі (згідно зі ступенями окиснення).
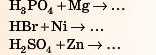
Для перевірки дивіться відповідь 3наприкінці параграфа.
- ДІЗНАЙТЕСЯ БІЛЬШЕ
Візьміть до уваги, що в реакціях кислот із металами є винятки. Внаслідок взаємодії металів із нітратною кислотою водень не виділяється. Це пов’язано з тим, що нітратна кислота містить у своїй молекулі сильний окисник (елемент, який «забирає» електрони) — Нітроген у ступені окиснення +5. Тому водень, який виділяється, негайно окиснюється N15 до води. Те саме відбувається й у реакціях із концентрованою сульфатною кислотою, у молекулі якої сірка S'6 також є окисником. Склад продуктів у цих окисно-відновних реакціях залежить від багатьох чинників: активності металу, концентрації кислоти, температури. Наприклад:
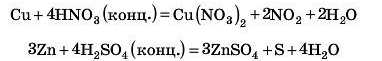
Більш докладно ми розглянемо ці реакції в старших класах.
5. Взаємодія кислот із солями
Для складання цих реакцій нам потрібно обов’язково дивитися в таблицю 13 (с. 242)або пам’ятати її.
Ми будемо керуватися таким правилом:
Більш сильні й нелеткі кислоти витісняють менш сильні й більш леткі з їх солей, якщо утворюється газ або осад.
Леткі кислоти — це безоксигенові кислоти й ті оксигеновмісні, які легко розкладаються з утворенням газоподібних оксидів: сульфітна, карбонатна.
Урахуйте, що сульфатна кислота витісняє майже всі кислоти з їх солей, у тому числі й ті, які в таблиці зазначені як сильні, наприклад НС1, тому що H2SO4 — і сильна кислота, і нелетка.
У результаті реакції утворюються теж кислота й сіль, але вже іншого складу. Це реакція обміну.
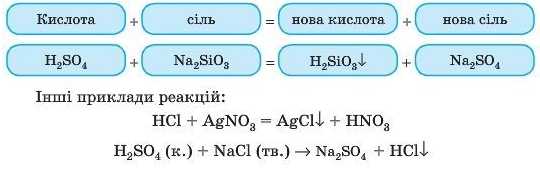
Досліа

Простий дослід: до харчової соди (у розчині або в порошку) додамо оцет. Цю реакцію іноді проводять домогосподарки: «гасять соду оцтом*. Що бачимо? Рясне виділення бульбашок газу. Це і є CO2, який утворився під час розкладу H2CO3.
Можна урізноманітнити цей простий дослід. Додайте в суміш мийний засіб — піна стане ряснішою та стійкішою. Можна, наприклад, виліпити конус із пластиліну, а потім зробити в ньому отвір і насипати туди соду, змішану з акварельною фарбою, потім додати оцет. Виверження вулкана готове! Ваші молодші сестрички й братики будуть у захваті. Можливо, ви самі придумаєте, як іще можна видозмінити цей дослід?
Зверніть увагу, що карбонатна кислота в чистому вигляді не існує, вона відразу нід час утворення розкладається на карбон(ІУ) оксид і воду:
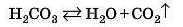
Сульфітна кислота теж легко розкладається на сульфур(ІУ) оксид і воду:
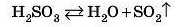
У рівняннях реакцій зазвичай записують не формули цих кислот, а відразу продукти розкладу — оксид і воду.
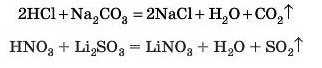
Для перевірки дивіться відповідь 4 наприкінці параграфа.
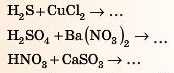
Отже, щоби краще запам’ятати властивості кислот, запишемо схему:
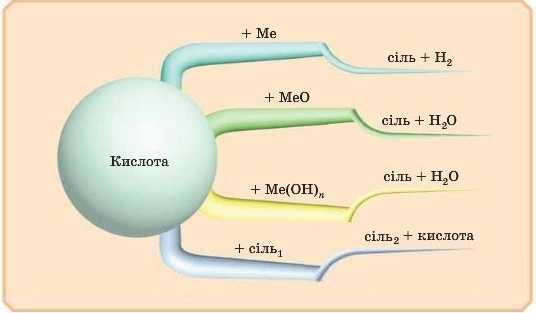
— Дуже легко запам’ятати: спочатку реагент — просто метал, потім метал із О, потім метал із ОН, а потім метал із кислотним залишком (сіль).
— Виявляється, оксид металу + кислота — вивчали, кислота + основа (будь-яка) — вивчали, тож треба лише запам'ятати забарвлення індикаторів і взаємодію з металами й солями.
ВІДПОВІДІ ДО ЗАВДАНЬ ПАРАГРАФА
Відповідь 1
Відповідь 2
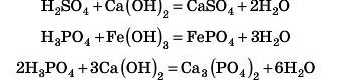
Відповідь З
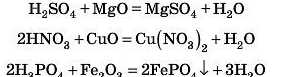
Відповідь 4
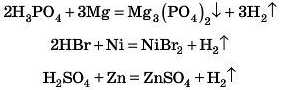
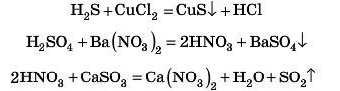
ПЕРЕВІРТЕ СВОЇ ЗНАННЯ
1. На які типи поділяють кислоти:
а) за основністю;
б) за розчинністю у воді;
в) за силою;
г) за вмістом атомів Оксигену?
Наведіть приклади.
2. З якими оксидами можуть взаємодіяти кислоти?
3. Як називають реакцію взаємодії кислот з основами?
4. Яку спол^'ку можна використати для нейтралізації сульфатної кислоти?
δ. З яким із наведених металів узаємодіє хлоридна кислота?
а) Cu; в) Mg;
б) Ag; г) Hg.
6. З якою сполукою не реагує нітратна кислота?

ВИКОНАЙТЕ ЗАВДАННЯ
1. Складіть формули кислот, знаючи їх кислотні залишки:
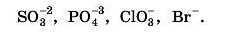
2. Напишіть реакції нейтралізації, у результаті яких утворюються такі солі:
а) Al2(SO4)3;
б) NiCl2;
в) Fe(NO3)3;
г) Mg3(PO4)2.
3. У правому стовпчику наведено назви солей, а в лівому — хімічні формули кислот, які утворюють солі. Розташуйте формули таким чином, щоби назва солі відповідала хімічній формулі кислоти.
а) Калій хлорид I) H2SO4
б) Барій нітрат 2) HCl
в) Кальцій сульфат 3) H2CO3
г) Куирум карбонат 4) HNO3
4. Укажіть рядок, де наведено речовини, з якими взаємодіє хло-ридна кислота:
1) цинк і натрій гідроксид;
2) мідь і купрум(ІІ) оксид;
3) ртуть і карбон(ІУ) оксид;
4) магній і натрій хлорид.
Напишіть відповідні рівняння реакцій.
5. Напишіть рівняння реакцій, із допомогою яких можна здійснити перетворення:
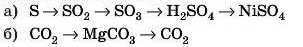
6. Виберіть метали, з якими реагуватиме хлоридна кислота: срібло, олово, магній, залізо, золото, ртуть, кобальт.
Напишіть рівняння можливих реакцій.
7. Яку кількість речовини кальцій гідроксиду й нітратної кислоти необхідно взяти, щоб вони прореагували повністю і при цьому утворилося 24,6 г солі?
8. Яку кількість речовини сульфатної кислоти треба взяти для повного розчинення 12 г магнію? Яка маса солі при цьому утворюється? Який об’єм водню за н. у. виділиться?
9. Яка маса солі утвориться внаслідок взаємодії 40 г кальцій оксиду з нітратною кислотою?
10. Обчисліть об’єм карбон(ІУ) оксиду, що виділився внаслідок узаємодії 12 г натрій карбонату з хлоридною кислотою.
11. Яка маса цинку буде потрібна для одержання 1,5 моль водню? Цинк взаємодіє із сульфатною кислотою. Яка маса кислоти потрібна для цього?
Це матеріал з підручника Хімія 8 клас Гранкіна
Автор: admin от 21-09-2016, 00:16, Переглядів: 9027