§ 26. Одержання основ. Їх поширення у природі й застосування
— Я знаю, як одержують основи — з основних оксидів! Ми вивчали це в «Оксидах».
— А я читала, що їх одержують розчиненням металів у воді.
— Але ж метали у воді не розчиняються, це всі знають!
— А от і розчиняються, але не всі. Читай параграф — сам дізнаєшся! Розчинні й нерозчинні основи одержують по-різному.
ОДЕРЖАННЯ НЕРОЗЧИННИХ ГІДРОКСИДІВ
Нерозчинні у воді основи й амфотерні гідроксиди одержують шляхом взаємодії відповідної розчинної солі з лугом:

Це реакція обміну.
Дослід
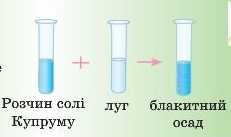
До блакитного розчину солі Купруму додайте розчин будь-якого лугу. Випаде блакитний осад. Напишіть рівняння реакції до цього досліду самостійно.
Два учні проводять реакцію між алюміній сульфатом і натрій гідроксидом з метою отримати алюміній гідроксид. Вони користуються одними й тими самими розчинами, але змішують їх у різному порядку: один доливав розчин солі до розчину лугу, інший — навпаки. Чому' в одного учня у пробірці утворюється незникаючий осад, а в іншого учня осад, що з’являється, зникає? Дайте обґрунтовану відповідь, навівши рівняння відповідних реакцій.
Для того, щоби дати обґрунтовану відповідь, проведіть цей експеримент.
До речі, із солей можна одержувати й луги, але за умови, що під час реакції має обов’язково утворюватися нерозчинна сіль:
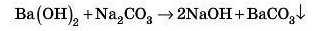
Так, використовуючи один луг, можна одержати інший.
ОДЕРЖАННЯ РОЗЧИННИХ ГІДРОКСИДІВ
В основному, луги одержують такими способами:
1. Взаємодія лужних і лужноземельних металів із водою:
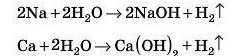
Це реакції заміщення.
Під час проведення цього досліду луг, що утворюється, можна визначити, крапнувши декілька крапель фенолфталеїну.
Лужні й лужноземельні метали дуже бурхливо реагують із водою, з виділенням великої кількості енергії. Завдяки своїй високій активності вони можуть зайнятися на повітрі й навіть вибухнути. Тому їх зберігають під шаром гасу або мінеральної олії, захищають від потрапляння на них води.
— От бачиш! Я ж говорила, що деякі метали бурхливо реагують із водою! Між іншим, одне зі значень старослов'янського слова «видужувати» — розчиняти. Раніше, за старих часів, білизну прали так: спалювали рослини, золу й попіл, які утворилися, промивали у воді, а отриманим розчином прали білизну. Навіть e таке російське слово — «щелок». Можливо, воно походить від німецького scholen — полоскати.
I s
— Значить, і назва металів «лужні# приблизно означає «розчинні#.
Згадайте, які елементи утворюють лужні метали? Так, це Li, Na, К, Rb, Cs. А лужноземельні? Все правильно: Ca, Sr, Ba.
2. Взаємодія оксидів лужних і лужноземельних металів із водою:

Це реакції сполучення. Ми вже розглядали що реакцію, коли вивчали властивості оксидів (див. § 21). Унаслідок взаємодії цих речовин виділяється велика кількість енергії. З урахуванням того, що утворюється їдкий луг, проведення цих реакцій вимагає великої обережності.
Дослід
Візьміть декілька шматочків CaO — негашеного вапна, акуратно додайте до них воду й опустіть в отриману суміш термометр. Яг; змінилася температура?
Зверніть увагу: тільки оксиди лужних і лужноземельних елементів утворюють у реакціях із водою луг.
Оксиди інших металів із водою не реагують, хоча, безсумнівно, є й винятки. Згадайте, ми вивчали: якщо гідроксид не розчиняється у воді, його не можна одержати взаємодією оксиду й води. Розчинність гідроксидів визначаємо за таблицею розчинності (див. форзац).
— Може, ти знаєш, звідки походить назва « лужноземельні»?
— Звичайно! Я ж розумна. «Землями» алхіміки називали оксиди. От і виходить, що «лужноземельні» — розчинні оксиди.
3. Електроліз розчинів солей:
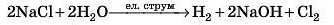
Під час електролізу електричний струм пропускають крізь розчин солі. Під його дією відбувається розклад одних речовин і утворення нових. Процес цей досить енерговитратний.
Цей дослід можна провести на уроці хімії (або після уроку). У підсолену воду опустіть шматочки дроту, з’єднані з клемами батарейки. У воду крапніть фенолфталеїн. У результаті побачимо активне виділення газів, а розчин забарвиться в малиновий колір. Поясніть, чому.
ПОШИРЕННЯ ОСНОВ У ПРИРОДІ
У природі луги не трапляються: по-перше, вони розчинні й будуть вимиватися водою, а по-друге, вони дуже активні й легко беруть участь у хімічних реакціях.
Нерозчинні основи можуть входити до складу деяких мінералів у вигляді основних солей. Іржа, яка утворюється на сплавах заліза, теж частково складається з гідроксидів Феруму.
ЗАСТОСУВАННЯ ОСНОВ
Каустична сода (вона ж натрій гідроксид, або їдкий натр) має мийні здатності, тому її використовують у складі багатьох засобів побутової хімії. У ній добре розчиняються жири, тому NaOH використовують для очищення масляних плям із різних виробів, для видалення жирових відкладень у каналізаційних трубах.
їдкий натр також застосовують для виготовлення целюлози в паперовій промисловості, виробництва олій на нафтопереробці, у хімічній промисловості. Його використовують у виробництві екологічно чистого біодизельного палива.
Інші галузі застосування їдкого натру — виробництво мила, штучних волокон, а також барвників. Дуже дивно, але цей луг використовують для виготовлення какао, морозива, шоколаду, хліба, напоїв.

Гашене ванно (кальцій гідроксид) дістало широке застосування будівництві для побілки й штукатурки стін. Будівельники назнають його «вапняне молоко» й «пушонка».
Наступна основа, яку застосовують у багатьох галузях промис-овості, — калій гідроксид (KOH) — їдке калі. Ця речовина є ви-ідною для одержання рідких мил, солей Калію й деяких видів арвників. Її використовують як електроліт в акумуляторах у спо-ученні з літій гідроксидом.
Літій гідроксидом (LiOH) можна наповнювати лужні акумуля-ори (батарейки), також його використовують у виробництві скла і емалей.
Нерозчинні й амфотерні гідроксиди використовують рідше. Ha-:риклад, купрум гідроксид (Cu(OH)2) використовують для надан-:я забарвлення склу й емалям.
Цинк гідроксид (Zn(OH)2) — компонент багатьох фарб і мазей. Для одержання каталізаторів і пігментів використовують ко-альт гідроксид (Co(OH)2).
Для виготовлення зубних паст, як адсорбуючий засіб у медици-:і застосовують алюміній гідроксид (Al(OH)3).
Mg(OH)2 застосовують як адсорбент у фільтрах для води. Mg(OH)2Ta Al(OH)3 застосовують як наповнювачі для пластмас ля надання їм негорючості.
З допомогою берилій гідроксиду (Be(OH)2) одержують вогне-ривку кераміку й компоненти стекол, які пропускають ультрафі-летові промені.
ПЕРЕВІРТЕ СВОЇ ЗНАННЯ
1. У результаті яких реакцій можна одержати нерозчинні основи?
2. Назвіть способи одержання розчинних основ.
3. У якій групі Періодичної системи розташовані лужні метали? лужноземельні метали?
ВИКОНАЙТЕ ЗАВДАННЯ
1. Який оксид під час розчинення у воді дає луг:

2. Ферум(ІІІ) гідроксид утворюється внаслідок дії розчинів лугів на таку речовину:
а) ферум(ІІ) оксид; в) розчини солей Феруму(ІІ);
б) ферум(НІ) оксид; г) розчини солей Феруму(ІІІ).
Напишіть рівняння відповідних реакцій. Обчисліть масу цинк гідроксиду, яку можна одержати зі 162 г цинк оксиду за цим перетворенням.

Відповідь нідтвердьте рівняннями реакцій. Обчисліть масу FeCl3, необхідну для одержання 321 г Fe(OH)3 згідно з цим перетворенням.
6. Цинк гідроксид може реагувати з кожною речовиною в парі:
1) кальцій сульфат, сульфур(УІ) оксид;
2) натрій гідроксид (розчин), хлоридна кислота;
3) вода, натрій хлорид;
4) барій сульфат, ферум(ІІІ) гідроксид.
Напишіть рівняння відповідних реакцій.
7. ^Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення речовин:
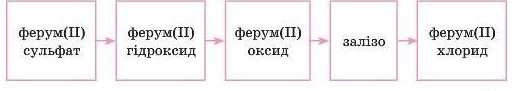
Обчисліть масу заліза, отриманого таким перетворенням із 38 г ферум(ІІ) сульфату. Яка маса хлоридної кислоти необхідна для розчинення цього заліза?
8. *До розчину цинк нітрату, який містить 160 г Zn(NO3)2, долили надлишок розчину натрій гідроксиду. Обчисліть маси утворених речовин.
для допитливих
1. Знаючи, що галій є аналогом алюмінію, напишіть рівняння реакцій одержання галій гідроксиду й рівняння, які характеризують його хімічні властивості.
2. В одній пробірці міститься розчин магній хлориду, а в іншій — алюміній хлориду. З допомогою якого одного реактиву можна з’ясувати, в яких пробірках містяться ці солі?
3. Є суміш ферум(ІІ) хлориду й алюміній хлориду. Суміш розчинили, до розчину додали надлишок розчину натрій гідроксиду, а осад, що з’явився, відфільтрували. Яка речовина міститься в осаді, а яка — у розчині? Напишіть рівняння реакцій.
4. Які властивості гідроксидів KOH, Mg(OH)2 можна використати для розділення їх твердої суміші? Відповідь обґрунтуйте.
5. Білий осад розчиняється у розчині нітратної кислоти й у розчині натрій гідроксиду. Яка речовина може входити до цього осаду? Відповідь підтвердьте рівняннями реакцій.
6. Наведіть приклад речовини, яка у водному розчині здатна реагувати з кожною з таких речовин: HNO3, NaOH. Напишіть рівняння реакцій.
ДОМАШНІ ЕКСПЕРИМЕНТИ
(Просимо допомоги батьків!)
Досліди необхідно проводити на кухні з відкритим вікном або працюючою витяжкою.
Перед виконанням експерименту треба підготувати собі на кухні робоче місце, надіти спеціальний одяг, заслати стіл клейонкою. Під час проведення досліду необхідно користуватися спеціальним посудом і обладнанням. Після закінчення роботи все прибрати та помити руки.
1. Ліки як індикатори
Розчини фурациліну і брильянтового зеленого — індикатори
Нітрофурал, або фурацилін C6H6N4O4 — антисептичний засіб. Найчастіше «Фурацилін» використовують для полоскання порожнини рота в разі захворювань, для лікування гнійних ран, пролежнів, виразкових уражень, опіків II та III ступенів.
Брильянтовий зелений C29H35N2O4 — блискучі кристали зеленого кольору. Спиртовий розчин цієї речовини («зеленка») є антисептичним засобом для зовнішнього й місцевого застосування.
Хід роботи
1. Одну жовту таблетку фурадиліну розтерти на папірці, висипати в одноразовий стаканчик і додати 100 мл дистильованої води (для швидкого розчинення можна використовувати гарячу воду або додати трошки кухонної солі).
2. В одноразовий стаканчик накапати обережно 2-3 краплі розчину брильянтового зеленого й додати 50-100 мл дистильованої або кип’яченої води.
3. До розчинів індикаторів у одноразові стаканчики додати розчин оцту (етанової кислоти) й розчин нашатирного спирту або питної соди, спостерігати за зміною забарвлення індикаторів.
Розчин нашатирного спирту має специфічний запах, у медицині його використовують для виведення людей зі стану запаморочення та втрати свідомості. Працювати з ним треба в добре провітрюваних приміщеннях, наприклад на кухні з відкритим вікном або працюючою витяжкою.
|
І-1 Середовшце/індикатор |
Розчин фурациліну |
Розчин брильянтового зеленого |
|
Кисле (етанова кислота) |
||
|
Лужне (розчин нашатирного спирту або питної соди) |
2. Готуємо індикатор із синьої капусти Приготування відвару із синьої капусти
Фіолетово-червоне забарвлення синьої капусти обумовлене наявністю речовин — антоціанів, що змінюють свій колір залежно від кислотності середовища.
Хід роботи
1. Дрібно нарізати (або натерти) синю капусту.
2. Залити кип’яченою водою, довести до кипіння і проварити 2-3 хвилини до появи забарвлення.
3. Охолодити, обережно вилити в підписану банку і зберігати в холодильнику.
4. Випробувати дію приготовленого індикатора на розчини, що мають кисле й лужне середовище. (Принести відвар на наступне заняття з хімії.)
δ. Випробувати дію індикаторів: розчину чаю «Каркаде», розчинів соків на розчини, що мають кисле й лужне середовище.
|
Середовище/ індикатор |
Відвар синьої капусти |
Розчин чаю «Каркаде» |
Розчин вишневого соку (можна взяти соки буряка, чорноплідної горобини, малини, смородини, синього винограду) |
|
Кисле (етанова кислота) |
|||
|
Лужне (розчин питної соди або нашатирного спирту)* |
Це матеріал з підручника Хімія 8 клас Гранкіна
Автор: admin от 21-09-2016, 00:15, Переглядів: 9324