§ 24. Вивчаємо основи, їхні фізичні й хімічні властивості
— Забилася раковина в кухні. Що робити?
— Можна прочистити хімічним засобом. Купимо потрібний, насиплемо його у зливальний отвір, хвилина — і все в порядку.
— Що ж входить до складу таких засобів?
— Читаємо: в одному — натрій гідроксид, в іншому — їдкий натр. Але це ж одна
й та сама речовина — луг NaOH!
Луги — досить агресивні речовини: вони легко розчиняють жири, ор ганічні речовини й навіть волосся. Це ви можете прочитати на зворо ті засобу для чищення. Луги належать до групи речовин, які називають основами.
СКЛАД І НАЗВИ ОСНОВ
Згадаємо, що основами називають складні неорганічні речовини, в яких йони металу пов’язані з одним або декількома гідро-ксид-іонами OH (див. § 18).
Ми вже вивчали, що назви основ складаються з двох слів: назви металу й слова «гідроксид»: NaOH — натрій гідроксид. Якщо в металі змінний ступінь окиснення, то його вказують римськими цифрами в дужках після назви металу: CuOH — купрум(І) гідроксид, Cu(OH)2 — купрум(ІІ) гідроксид (див. § 18).
Деякі луги та їх розчини мають і традиційно сформовані назви, в яких указано їхні властивості. Наприклад: NaOH — їдкий натр, каустична сода; KOH — їдке калі; Ca(OH)2 — гашене ванно; Ba(OH)2 — їдкий барит, баритова вода.
ДІЗНАЙТЕСЯ БІЛЬШЕ
Існує також основа (луг), в якій гідроксигрупа приєднана не до металу, а до йона NH4 (катіона амонію). Цю основу називають амоній гідроксид, вона існує тільки у вигляді йонів у розчині й не виділяється у вигляді чистої речовини, тому її формула NH4OH може бути тільки умовною. У побуті й медицині цей луг відомий за назвою «нашатирний спирт».
ФІЗИЧНІ ВЛАСТИВОСТІ основ
Більшість основ — йонні сполуки. Тому зазвичай вони є твердими речовинами. Густина, температури кипіння й плавлення основ змінюються в широких межах. Всі луги білого кольору, нерозчинні основи можуть бути забарвлені в різні кольори.
Так, купрум(ІІ) гідроксид блакитного кольору, ферум(ІІІ) гідроксид — бурого, нікол(ІІ) гідроксид — ніжно-зеленого тощо.

Розчини лугів слизькі на дотик («мильні») і досить їдкі. Вони роз’їдають шкіру, тканини, папір, дуже небезпечні (як і кислоти) в разі потрапляння в очі.
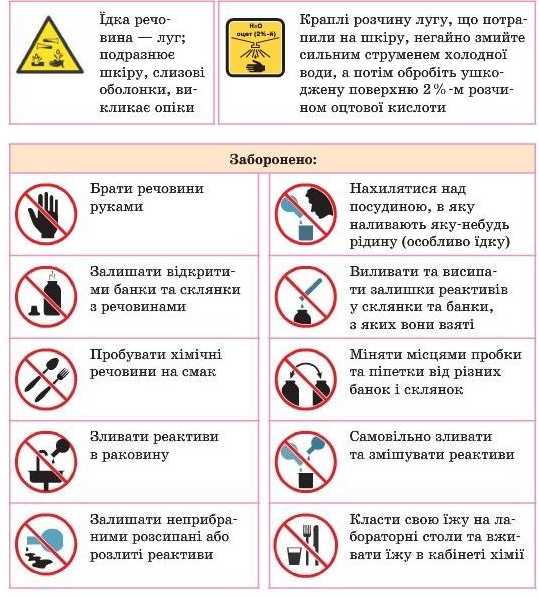
ПРАВИЛА РОБОТИ З ЛУГАМИ
Увага! У разі потрапляння на руки розчину лугу слід змити його проточною водою до зникнення почуття милкості, потім обробити шкіру слабким розчином етанової або борної кислоти. Запам’ятайте: треба обов’язково вимити руки після роботи з реактивами!
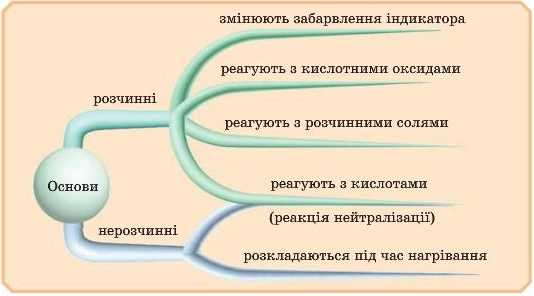
ХІМІЧНІ ВЛАСТИВОСТІ
Луги — більш хімічно активні, тобто більш сильні, ніж нерозчинні основи: вони реагують з великою кількістю речовин, реакції відбуваються швидше й більш бурхливо.
Всі луги — сильні основи, всі нерозчинні основи — слабкі.
Щоби визначити, чи є основа лугом, досить подивитися в таблицю розчинності. Знайдіть ряд, позначений OH-. Якщо в місцях перетину його з вертикальними стовпцями з позначенням йонів металів стоять літери «Р» (розчинна сполука), це луги.
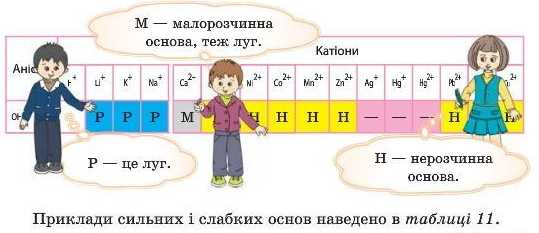
Таблиця 11
Класифікація основ за їхньою силою
|
Сильні основи |
Слабкі основи |
|
NaOH натрій гідроксид KOH калій гідроксид LiOH літій гідроксид Ba(OH)2 барій гідроксид Ca(OH)2 кальцій гідроксид |
Mg(OH)2 магній гідроксид Fe(OH)2 ферум(ІІ) гідроксид Cu(OH)2 цинк гідроксид Ni(OH)2 ферум(ІП) гідроксид і т. д. (більшість гідроксидів металів) |
Хімічні властивості розчинних основ
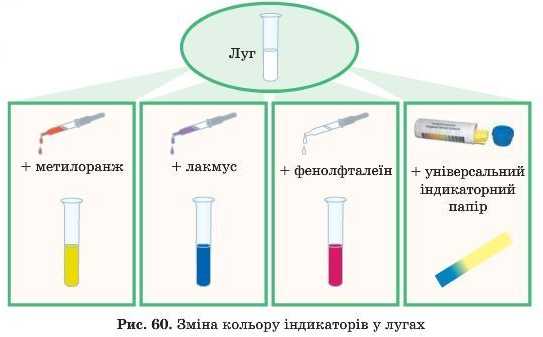
1. Зміна забарвлення індикатора
Індикатори — речовини, які змінюють своє забарвлення в нейтральному, кислому або лужному середовищі.
Якщо в розчині є надлишок йонів H', який утворюється, наприклад, під час розчинення кислот, говорять, що середовище розчину кисле. Якщо в розчині міститься надлишок йонів OH , які можуть з’явитися там, наприклад, під час розчинення лугів, то середовище розчину називають лужним. Якщо немає в надлишку ні тих, ні інших йонів, то середовище розчину називають нейтральним (наприклад, чиста вода).

тс
Дослід
У розчин лугу додамо декілька крапель безбарвної речовини — фенолфталеїну. Розчин відразу забарвиться в гарний малиновий колір.

Чому розчин забарвився? Під час розчинення лугів у воді утворюються йони ОН~.
Фенолфталеїн — індикатор. А це означає, що він у присутності йонів OH- набуває певного забарвлення, чим показує нам, що в розчині міститься луг.
Є й інші індикатори, які покажуть нам, що розчин має лужне середовище: фіолетовий лакмус стане синім, оранжевий метилоранж — жовтим.
Індикатори часто використовують у вигляді розчинів, але їх розчинами можна просочити спеціальний напір — і в результаті отримаємо індикаторний напір.
Часто використовують індикаторний напір жовтого або білого кольору. У лужному середовищі він стає синім.
— А я знаю як запам’ятати зміну кольору фенолфталеїну: фенолфталеїновий у лугах малиновий! От які вірші корисні!
- ДІЗНАЙТЕСЯ БІЛЬШЕ
Одна з найважливіших властивостей водних розчинів — їх кислотність або лужність, яка визначається концентрацією йоііів H+ і OH"". Для кількісного визначення кислотності або лужності розчину (часто говорять «середовища») використовують водневий показник — pH («не аш»). Кожне значення pH відповідає певному вмісту катіонів Гідрогену віл розчину.
У розчинах кислот уміст катіонів H+ збільшується, а вміст гід-роксид-іонів зменшується, у розчинах лугів спостерігається зворотна ситуація. Відповідно до цього змінюється й значення водневого показника (pH).
За кімнатної температури в нейтрачьних розчинах pH = 7, у кислих розчинах pH < 7, а в лужних pH > 7. Приблизне значення pH водного розчину можна визначити з допомогою індикаторів.
Наприклад, метиловий оранжевий за pH <3,1 має червоний колір, а за pH > 8,4 — жовтий; лакмус за pH <6,1 має червоний колір, а за pH >9 — синій і т. д. Спробуйте самі визначити яким є середовище за таких показань pH.
Більш точно (до сотих часток) значення pH можна визначити з допомогою спеціальних приладів — pH-метрів.
2. Взаємодія лугів із кислотними оксидами
Дослід
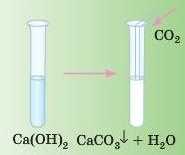

Проведемо дослід: будемо продувати крізь розчин Ca(OH)2 через трубочку видихуване повітря.
Розчин каламутніє.
Відбулася взаємодія вуглекислого газу, який містився у видихуваному повітрі, з кальцій гідроксидом. У результаті утворився нерозчинний кальцій карбонат, який і спричинив помутніння розчину. Це реакція обміну.
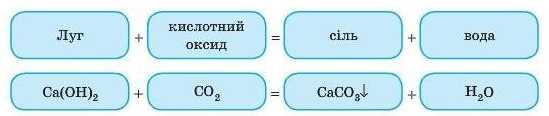
Реакцію взаємодії лугів із кислотними оксидами ми вже вивчали, коли розглядати властивості оксидів. Ви маєте пам’ятати, що під час складання цих рівнянь слід розуміти, яка
кислота відповідає певному оксиду. У згаданому вище прикладі оксиду CO2 відповідає кислота H2CO3, тому до складу солі входить залишок цієї кислоти CaCO3.
Завдання. Спробуйте самі закінчити такі рівняння реакцій.
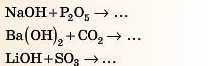
Для перевірки подивіться відповідь 1наприкінці параграфа.
3. Взаємодія лугів із солями
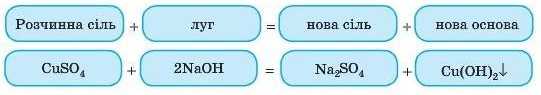
Ця реакція відбувається тільки в тому випадку, коли в реакцію вступає розчинна сіль, а в результаті реакції утворюються нерозчинні сполуки. Звичайно, у цьому нам допоможе «Таблиця розчинності». Тип реакції — обмін.
Реагенти розчинні => у продуктах осад.
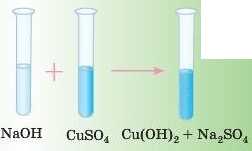
Дослід
До безбарвного розчину натрій гідроксиду додамо блакитний розчин KynpjiiM(II) сульфату. Утворюється гарний блакитний осад купрум(ІІ) гідроксиду.
Приклад. Спроб>гйте самі закінчити такі рівняння реакцій.
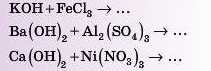
Для перевірки подивіться відповідь 2наприкінці параграфа.
4. Реакція нейтралізації
Усі основи (розчинні й нерозчинні) мають спільну властивість. Це взаємодія з кислотами, у результаті якої утворюються сіль і вода. Тип реакції — обміну, а її персональна назва - реакція нейтралізації.
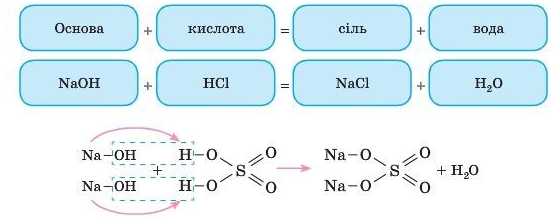
Така схема наочно показує відмінність між кислотами й основами: кислоти відщеплюють йони Гідрогену, а основи — гід-роксид-іони.
Цю реакцію використовують для нейтралізації лугів на шкірі. Перегляньте ще раз правила роботи з лугами.
Завдання. Спробуйте самі закінчити такі рівняння реакцій.
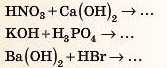
Для перевірки подивіться відповідь 3 наприкінці параграфа.
Учитель викликав вас до дошки показати експериментально взаємодію кислоти й основи. Кислота — безбарвна рідина, луг — безбарвна рідина, а якщо ви їх змішаєте, утвориться безбарвний розчин солі й така сама вода. Взаємодії не видно. Запропонуйте порядок проведення цього експерименту так, щоби дійсно було видно взаємодію речовин. Якщо не знаєте як — підказка наприкінці параграфа.
5. Властивості нерозчинних і слабких основ
Нерозчинні та слабкі основи розкладаються за нагрівання утворюючи оксид і воду. Це реакція розкладу.
Дослід
Нагріємо блакитний осад купрум(ІІ) гідроксиду. Він досить швидко розкладається, утворюючи чорний осад купрум(П) оксиду й воду.
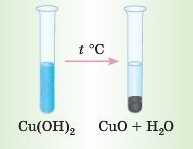
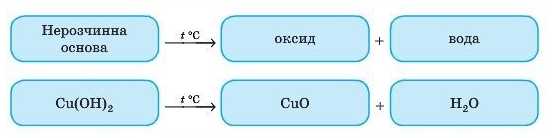
Завдання. Спробуйте самі закінчити наведені рівняння реакцій.
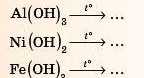
Для перевірки подивіться відповідь 4наприкінці параграфа.
— Для нерозчинних основ слід запам'ятати лише дві властивості:
• вони реагують із кислотами;
• розкладаються за нагрівання.
ВІДПОВІДІ ДО ЗАВДАНЬ ПАРАГРАФА
Підказка до «Мозкового штурму»: спочатку треба в розчин лугу додати фенолфталеїн. А далі думайте самі...
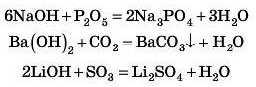
Відповідь 1
Відповідь 2
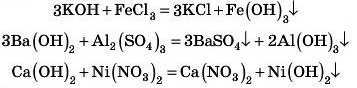
Відповідь З
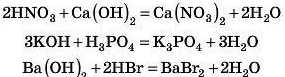
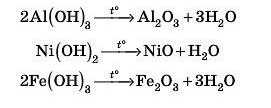
Отже, підіб’ємо підсумок:
Відповідь 4
- ДІЗНАЙТЕСЯ БІЛЬШЕ
Дуже велике значення має показник pH у нашому організмі. Наприклад, активність ферменту пепсину, який каталізує гідроліз білків і сприяє, таким чином, перетравленню білкової їжі в шлунку, максимальна за значень pH близько 2. Тому для нормального травлення необхідно, щоби шлунковий сік мав високу кислотність і, відповідно, досить низькі значення pH: у нормі 1,53-1,67.
У клітинах організму pH має значення близько 7, у позаклітинній рідині — 7,4.
На шкірі й волоссі людини зазвичай слабкокисле середовище. Тому мийні засоби, наприклад, для посуду зараз роблять так, щоб у них середовище теж було слабкокислим або нейтральним, тому часто на флаконах ви можете бачити написи: pH = 7 або pH = 5,5. У лужному середовищі легше відділяється жир, але таке середовище шкідливе для шкіри рук.
Велике значення мають вимірювання pH дощової води, яка може виявитися досить кислою через присутність у ній сульфатної та нітратної кислот. Ці кислоти утворюються в атмосфері з оксидів Нітрогену й Сульфуру(ІУ), які потрапляють у неї з відходами численних виробництв, транспорту, котелень і ТЕЦ. Відомо, що кислотні дощі з низьким значенням pH (менше 5,6) знищують рослинність, живий світ водойм. Тому екологи постійно контролюють pH дощової води.
ПЕРЕВІРТЕ СВОЇ ЗНАННЯ
1. Які сполуки називають основами?
2. Якого правила техніки безпеки необхідно дотримуватися під час роботи з основами?
3. Які традиційні назви лугів ви знаєте? Які властивості лугів вони характеризують?
4. Виберіть ряд, у якому наведено тільки луги:
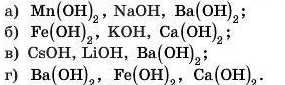
' 'Δ ' ·Δ ' 'Δ
5. До якого типу реакцій належить взаємодія між лугом і сіллю?
а) Заміщення; в) розкладу;
б) обміну; г) гідролізу.
ВИКОНАЙТЕ ЗАВДАННЯ
1. З якою речовиною може взаємодіяти КОН?
а) Алюміній хлорид;
б) натрій гідроксид;
в) ферум(ІІ) гідроксид;
г) магній оксид.
Напишіть рівняння реакції.
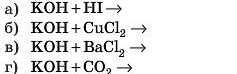
2. Закінчіть можливі реакції, порівняйте отримані рівняння. Поясніть ваше рішення.
3. Під час прожарювання Cr(OH)3 утворюються вода й така речовина:
✓ хром(ІІ) оксид; ✓ хром(УІ) оксид;
✓ хром(ІП) оксид; <✓ хром.
Напишіть рівняння реакції.
4. Напишіть рівняння реакцій, із допомогою яких можна здійснити перетворення:
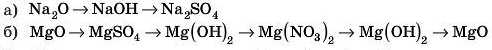
о. Який гідроксид вступає в реакцію нейтралізації за схемою:
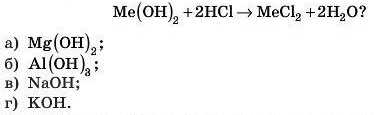
Напишіть рівняння реакції. Обчисліть масу цього гідроксиду, якщо відомо, що утворилося 1,5 моль солі.
6. Необхідно нейтралізувати розчин, який містить 180 г сульфатної кислоти. Яку масу гашеного ванна необхідно для цього використати?
7. Закінчіть рівняння реакцій:

Визначте число молів кожної отриманої речовини в обох реакціях, якщо відомо, що було взято однакові маси кожного гідроксиду — по 120 г.
Це матеріал з підручника Хімія 8 клас Гранкіна
Автор: admin от 21-09-2016, 00:14, Переглядів: 5013