§ 23. Одержання оксидів. Оксиди у природі, їх застосування
— Дивися, горить папір.
— А залізо іржавіє.
— І сірка.
— І вугілля.
— Із результаті всіх цих реакцій утворюються оксиди.
ОДЕРЖАННЯ ОКСИДІВ

Оксиди одержують не тільки в невеликих кількостях у хімічній лабораторії, але й у промислових масштабах. Так, у Харківському інституті монокристалів вирощують кристали алюміній оксиду. Після дода вання йонів Титану й Феруму вони набувають синього кольору й називаються сапфірами. Сапфір — дуже жароміцний і твердий кристал (другий за твердістю після алмаза), хімічно інертний. Ці кристали застосовують у військовій, хімічній промисловості, в оптоелектроніці. для виготовлення лінз, кістко вих протезів, скальпелів і т. д.
Оксиди одержують різними способами. Розглянемо деякі з них.
1. Оксиди утворюються внаслідок взаємодії простих речовин із киснем — реакції горіння або повільне окислення (гниття, іржавіння).
Якщо при цьому утворюються вищі оксиди (в яких ступінь окиснеиия елемента дорівнює номеру групи), то ці реакції ще називають повним окисленням:
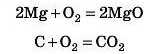
Може відбуватися й неповне окисненпя:
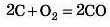
CO — чадний газ, украй отруйний. Утворюється в результаті неповного згоряння органічного палива. Тому необхідно стежити за надходженням повітря, наприклад, під час роботи газових плит.
2. Окиснения нижчих оксидів до вищого оксиду:
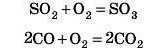
3. Під час горіння складних речовин також утворюються оксиди:
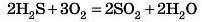
Під час горіння речовин, до складу яких входить Гідроген, вода утворюється завжди, а от другий елемент може окис-нюватися до різних речовин залежно від умов. Так може статися за нестачі кисню: 2H2S + O2 = 2S + 2Н20
4. Оксиди утворюються і під час термічного розкладу нерозчинних гідроксидів:
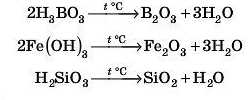
Знову повертаємося до поняття «відповідність оксидів гідроксидам» . Унаслідок взаємодії, наприклад, оксиду Fe2O3 з водою не можна одержати гідроксид Fe(OH)g. Але цей гідроксид розкладається за нагрівання до відповідного оксиду (до Fe2O3). Важливо те, що ступені окиснення Fe в оксиді й гідроксиді однакові.
5. Під час термічного розкладу деяких солей:
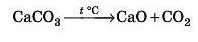
ПОШИРЕННЯ ОКСИДІВ У ПРИРОДІ
У літосфері Землі найбільше міститься силіцій(ІУ) оксиду. Загальне число мінералів, до складу яких входять силікати, становить близько 800. На їх частку припадає більше 90% мінералів літосфери.
Кристалічний силіцій(ІУ) оксид, або кремнезем SiO2, поширений у вигляді мінералу кварцу, який є основною складовою частиною гранітів, гнейсів, піщаників, польових шпатів і звичайного піску.

Утворені за певних умов кристали кварцу, часто з домішками, що забарвлюють його, являють собою такі мінерали: гірський кришталь (білий, прозорий), моріон (чорний), аметист (фіолетовий), димчастий кварц, або раухтопаз (від сірого до коричневого), рожевий кварц. Вони широко відомі як дорогоцінні й виробні камені. Крім того, до різновидів кварцу належать водомісткі мінерали: опал, халцедон (агат, карнеол, яшма) і кремінь.

Кристали силіцій(ІУ) оксиду містяться в деяких рослинних і тваринних організмах (деякі злаки, очерет, бамбук, кременисті губки й водорості).

Берилій оксид входить до складу мінералу берилу, деякі різновиди якого є дорогоцінними каменями, наприклад смарагд. Смарагд — це прозорий берил, забарвлений у трав’янисто-зелений колір хром(ІІ) оксидом або ванадій(У) оксидом із домішкою ферум(ІІ, III) оксиду. Великі смарагди масою більше δ каратів цінують дорожче алмазів.

- ДІЗНАЙТЕСЯ БІЛЬШЕ

Карат (від грецького кератіон (κεράτιον), англ. corat, нім. Karotn) — одиниця маси, яку використовують для коштовних каменів. Карат дорівнює 200 мг. Історично назва походить від назви рослини — дерева кароб, ріжкового дерева (Ceratonia siliqua). Насінини цієї рослини мають напрочуд сталу масу, тому їх використовували в деяких країнах як стандарт для зважування коштовного каміння.
До різновидів берилу належить аквамарин. Його блакитнувато-зелений колір обумовлений йонами Феруму. Родовища аквамарину є в Україні в Карпатах.
Мінералами, які містять алюміній оксид, є каолін (Al2O3-2Si02 ·2Η2θ), глиноземи (суміші каолінів із піском, вапняком, магнезитом), боксити (ALO3 H2O), корунд (Al2O3), польовий шпат (K2O-Al2O3-6Si02), кріоліт (Na3AlFe).

ДІЗНАЙТЕСЯ БІЛЬШЕ
«Достатньо вказати на те, що він входить до складу глини, щоби зрозуміло було загальне поширення алюмінію в корі земній... Алюміній, або метал галунів (alumen), тому й називають інакше глінієм, бо міститься в глині», — писав Д. І. Менделєєв.
Однак Al2O3, крім звичайної глини, утворює також дорогоцінні камені.

ДІЗНАЙТЕСЯ БІЛЬШЕ
Вуглекислий газ
Часто можна чути зовсім неправильну фразу: «Ми вдихаємо кисень, а видихаємо вуглекислий газ». Звичайно, це не так! Ми вдихаємо повітря, в якому 21% кисню за об’ємом, 78% азоту
і близько 0,03 % вуглекислого газу (решта — інші гази), а видихаємо повітря, в якому об’ємна частка вуглекислого газу збільшилася до 4-5 %, а кисню зменшилася до 15-16 %.
За вмісту CO2 У повітрі близько 15% виникає запаморочення, можлива втрата свідомості. Це отруйний газ.
Вуглекислий газ зелені рослини використовують у процесі фотосинтезу. Саме з нього й води утворюються органічні речовини, які потім використовують у їжу тварини (і ми з вами).
ЗАСТОСУВАННЯ ОКСИДІВ
Багато елементів поширені у природі у вигляді оксидів, наприклад руди, які містять Ферум: магнітний залізняк — Fe3O4 (суміш оксидів FeO Fe2O3), червоний залізняк— Fe3O4, бурий залізняк — 2Fe304 · ЗН20; алюмінієва руда боксит — Al2O3 · /гН20 і т. д.

Із цих оксидів одержують метали. Наприклад, у доменній печі відбувається відновлення оксидів Феруму з утворенням металічного заліза:
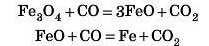
Сплави на основі заліза — чавун і сталь — люди застосовують найчастіше.
Оксиди застосовують дуже широко. Ми вже говорили про ювелірні й виробні камені, про виробництво чавуну й сталі. З алюміній оксид>' одержують алюміній, а потім сплави на його основі. їх використовують у літакобудуванні, будівництві, для виготовлення побутових виробів і т. д. Якщо оксиди нерозчинні у воді, то люди вміло використовують і цю їхню властивість. Наприклад, цинк
оксид ZnO — речовина білого кольору, тому її використовують для приготування білої олійної фарби (цинкові білила).
Оскільки ZnO майже не розчинний у воді, то цинковим білилом можна фарбувати будь-які поверхні, у тому числі й ті, які зазнають впливу атмосферних опадів. Нерозчинність і неотруйиість дозволяють використовувати цей оксид для виготовлення косметичних кремів, пудри. Фармацевти роблять із нього в’язкий і иідсушуваль-ний порошок для зовнішнього застосування.

Такі самі цінні властивості має титан(ІУ) оксид — TiO2. Він теж має гарний білий колір, його застосовують для виготовлення титанових білил. TiO2 не розчиняється не тільки у воді, але й у кислотах, тому покриття з цього оксиду особливо стійкі. Цей оксид додають у пластмасу для надання їй білого кольору. Він входить до складу емалей для металічного й керамічного посуду.
Хром(ІІІ) оксид Cr2Oa (амфотерний оксид) — дуже міцні кристали темно-зеленого кольору, не розчинні у воді. Cr2O3 використовують як пігмент (фарбу) під час виготовлення декоративного зеленого скла й кераміки.
Відома багатьом наста ГОИ (скорочення від найменування «Государственньїй оптический институт») містить цей оксид. Її застосовують для шліфування й полірування оптики, металічних виробів, у ювелірній справі.

Завдяки нерозчинності й міцності хром(ІІІ) оксид використовують і в поліграфічних фарбах. Взагалі, оксиди багатьох металів застосовують як пігменти для найрізноманітніших фарб.
ПЕРЕВІРТЕ СВОЇ ЗНАННЯ
1. Назвіть способи одержання оксидів.
2. Наведіть приклади застосування оксидів.
3. Який оксид рослини використовують у процесі фотосинтезу?
4. Назвіть формулу оксиду, який за звичайних умов перебуває в рідкому стані.
5. Які газоподібні оксиди ви знаєте?
6. Чи можна одержати силікатну кислоту внаслідок взаємодії силіцій(ІУ) оксиду й води?
7. З якими складними речовинами реагують оксиди, утворені неме-талічними елементами? Про які властивості свідчать ці реакції?
ВИКОНАЙТЕ ЗАВДАННЯ
1. Складіть рівняння горіння магнію, літію, вуглецю в кисні. Вкажіть назви отриманих оксидів. Зобразіть їх структурні формули.
2. Складіть рівняння горіння сірки, кальцію, стронцію, барію й фосфору. Укажіть назви отриманих речовин.
3. З яких гідроксидів можна одержати оксиди: Cr2O3, ZnO, FeO, Fe2O3, Al2O3, SiO2?
Напишіть відповідні рівняння реакцій.
4. Допишіть рівняння реакцій, якщо відомо, що утворюються два оксиди:
H2Se+ O2 —» селен(ІУ) оксид +...
MgS+ O2 -+ сульфур(ІУ) оксид +...
C2H4O+ O2-+ карбон(ІУ) оксид +...
Li2Se+ O2 —> селеи(ГУ) оксид +...
C2H4O+O2 —> карбон(ГУ) оксид +...
C12H22On +O2 карбон(ІУ) оксид +...
C6H12O6 + O2 -+ карбон(ІУ) оксид +...
Назвіть продукти реакцій.
δ. Карбон(ГУ) оксид реагує з кожною із двох речовин:
а) водою й кальцій оксидом;
б) киснем і сульфур(ІУ) оксидом;
в) калій сульфатом і натрій гідроксидом;
г) фосфатною кислотою й воднем.
ПРОДОВЖУЄМО НАВЧАТИСЯ РОЗВ'ЯЗУВАТИ ЗАДАЧІ
У попередніх задачах в умові було дано кількість речовини реагенті або продукту реакції. А якщо в умові дано масу або об'єм, і все? Як розв'я зувати?
Обчислення об'ємів і мас за відомими об'ємами або масами продуктів реакції або реагентів
Приклад. Яку масу азоту і який об’єм водню потрібно взяти для одержання 11,2 л амоніаку (н. у.)?
1) Записуємо рівняння реакції:
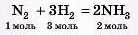
2) Визначаємо кількість речовини амоніаку, яка дана в задачі:
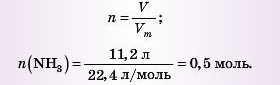
3) Визначаємо кількість речовини водню:
зарівнянням: 3 моль (H2) — 2 моль (NH3); заданими задачі: х моль (H2) — 0,5 моль (NH3),
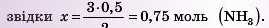
4) Переводимо цю кількість речовини в об’єм:
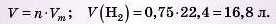
5) Обчислюємо масу азоту. Для цього використовуємо вже обчислену кількість речовини амоніаку: за рівнянням: 1 моль (N2) - 2 МОЛЬ (NH3); за даними задачі: х моль (N2) — 0,5 моль (NH3),
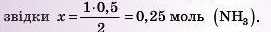
6) Переходимо від кількості речовини азоту до його маси:
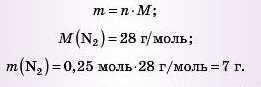
Відповідь: для одержання 11,2 л амоніаку необхідно 16,8 л водню й 7 г азоту.
Задачі такого типу можна розв’язувати методом складання пропорцій із використанням мас і об’ємів реагентів.
Приклад. Який об’єм водню (н. у.) необхідний для взаємодії з 3,5 г азоту в реакції синтезу амоніаку?
Розв'язання
1) Записуємо рівняння реакції:
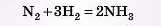
2) Над рівнянням записуємо дані задачі й х. Під рівнянням — маси й об’єми речовин, отримані за формулами т = п-M і V = Ji-Vmt де число моль п — це коефіцієнт у рівнянні реакції:

Зверніть увагу, що якщо в задачі дано (або запитують) масу речовини, то під ним у рівнянні реакції також обчислюють масу з використанням молярної маси, а якщо об’єм газу — також має бути обчислений об’єм із використанням молярного об’єму газу.
3) Складаємо й розв’язуємо пропорцію:
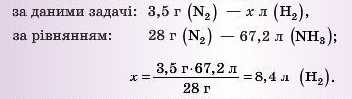
Відповідь: для взаємодії з азотом масою 3,5 г необхідно 8,4 л юдню.
Розв'яжіть самостійно
1. У реакцію з фосфор(У) оксидом вступила вода масою 27 г. Якою є маса ортофосфатної кислоти, що утворилася?
Відповідь: 98 г.
2. Скільки літрів кисню й водню (н. у.) можна одержати під час повного розкладу 360 г води електричним струмом?
Відповідь: 448 л H2; 224 л O2.
3. Гідроген сульфід об’ємом 5,6 л (н. у.) спалили в достатній кількості кисню. Обчисліть маси продуктів реакції.
Відповідь: 16 г SO2; 4,5 г H2O.
4. Складіть рівняння горіння сірки. Якщо згоряє 80 г сірки, то який об’єм газу (н. у.) утворюється?
Відповідь: 56 л.
δ. Магній масою 40 г спалили в кисні. Обчисліть масу отриманого магній оксиду.
Відповідь: 66,7 г.
6. '^Обчисліть об’єм кисню (н. у.), потрібний для спалювання 12 г вугілля з утворенням вуглекислого газу. Яка маса кальцій гідроксиду знадобиться, щоби поглинути весь утворений карбон(ІУ) оксид? (Припустіть, що утворюється тільки середня сіль.)
Відповідь: 22,4 л O2; 74 г Ca(OH)2.
7. *Залізо згоряє на повітрі, утворюючи залізну окалину Fe3O4.
а) Напишіть рівняння реакції.
б) Яка кількість речовини кисню знадобиться для згоряння 4 моль заліза?
в) Скільки літрів кисню становить ця кількість речовини за н. у.?
г) Чи може зразок заліза масою 5,6 г повністю перетворитися на Fe3O4 у носудині, яка містить 0,05 моль кисню?
Відповідь: б) 2,67 моль O2; в) 59,8 л; г) ні.
ДЛЯ допитливих
1. Нітроген(І) оксид за кордоном застосовують у стоматологічних клініках. Інші його назви — закис азоту, або звеселяючий газ. Чому в нього такі назви? Цей газ використовують також автомобілісти для прискорення руху. Форсаж — от як це називається. Відомо, що вперше з цією метою його застосували в німецьких літаках «Мессершмідтах» під час Другої світової війни. Поясніть принцип, який є основою такого використання нітроген(І) оксиду.
2. Відомо, що кремній у чистому вигляді в природі не трапляється, а поширений, в основному, у вигляді оксиду SiO2. Цей оксид, як ми знаємо, у воді не розчинний. Як ви прокоментуєте напис на машинах із питною водою «Збагачена кремнієм»?
3. Випалюванням ванняку одержують негашене ванно. Під час гасіння його водою утворюється гашене вапно, яке використовують у будівництві: згодом воно твердне, тому що реагує з вуглекислим газом повітря. Визначте хімічні назви речовин, які трапляються в тексті, та напишіть наведені рівняння реакцій.
4. Сурик, мумія, охра, умбра, колхотар — це назви фарби на основі... Який оксид входить до складу цієї фарби? Який у неї колір?
δ. «Алюміній — дуже активний метал, він бурхливо реагує з водою з утворенням водню...» — прочитав учень у підручнику з хімії. «Не може бути, — подумав він, — це неправда. А як же алюмінієві ложки або дроти? Вони ж у воді не розчиняються!» Допоможіть учню розібратися в цьому питанні. Чи можна в алюмінієвому посуді тримати розчини кислот? лугів?
6. Які оксиди використовують для одержання фарб? Які кольори вони дають?
7. Зустрілися господарки.
— Я використовую цей газ, коли готую підвал до зими.
— А я з його допомогою борюся з хворобами винограду.
— А я відбілюю соломку для моїх декоративних виробів.
Що це за газ, якщо відомо, що він проявляє властивості кислотного оксиду?
8. Увечері друзі довго засиділися біля багаття. Вогню вже не було, але по розпечених вугіллячках пробігало синє полум’я. «Я знаю, що це за синє полум’я. Це ж згоряє...» Закінчіть речення. Чому утворилася ця речовина?
9. Яка речовина під час термічного розкладу утворює три оксиди в різних агрегатних станах?
10. Чи можна сульфур(УІ) оксид, який містить випари води, осушити з допомогою кальцій оксиду? Дайте обґрунтовану відповідь.
11. Один із технічних способів одержання сажі (C) полягає в нагріванні CO під тиском у присутності каталізаторів. Складіть рівняння реакції, яка відбувається при цьому, знаючи, що газ, який утворюється разом із сажею, може поглинатися розчином лугу.
ДОДАТКОВІ ЗАДАЧІ
1. Невідомий елемент входить до складу оксиду RO2, відносна формульиа маса цього оксиду дорівнює 60. Визначте невідомий елемент. Напишіть рівняння реакцій одержання цього оксиду з простої речовини R і складної речовини RH4.
2. Невідомий елемент розташований у четвертій групі Періодичної системи й утворює оксид, де він проявляє найвищу валентність. Відносна молекулярна маса сполуки дорівнює 44. Визначте цей елемент.
Напишіть формулу сполуки цього елемента з Гідрогеном, де він проявляє таку саму вачентність, що й в оксиді. Напишіть структурну формулу цієї сполуки.
3. Графіт — одна з форм карбону — горить на повітрі, утворюючи
вуглекислий газ.
а) Напишіть рівняння реакції горіння.
б) Обчисліть, яка кількість речовини CO2 утворюється в результаті згоряння 1 моль графіту. Яку масу має ця кількість CO2?
в) Яка кількість речовини вуглекислого газу утворюється під час згоряння 24 г графіту?
Який об’єм вона займе за н. у.?
г) Обчисліть, яка кількість речовини CO2 може утворитися в посудині, що містить 10 моль газуватого кисню, якщо кількість графіту є достатньою.
4. Під час нагрівання вапняку CaCO3 утворюються кальцій оксид
і вуглекислий газ. Виходячи з цього:
а) складіть рівняння реакції, вкажіть її тип;
б) обчисліть масу кальцій оксиду, якщо об’єм утвореного вуглекислого газу становить 11,2 л (н. у.);
в) визначте, яка кількість речовини CO2 утворюється, якщо розклалося 25 г CaCO3.
Це матеріал з підручника Хімія 8 клас Гранкіна
Автор: admin от 21-09-2016, 00:13, Переглядів: 3709