§ 20. Гідроксиди й безоксигенові кислоти гідроксиди
— От дивися, дві структурні формули:
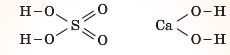
Що в них спільного?
— У них є групи -ОН.
— Ці групи називають гідроксильними, а сполуки, до складу яких вони входять, належать до гідроксидів. Тільки одна з них кислота, а інша — основа.
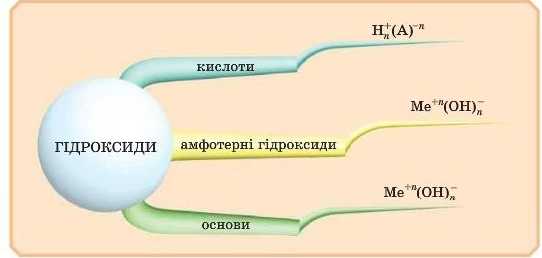
Гідроксиди — це клас неорганічних сполук, до складу яких входить гідроксильна група — йои OH .
• Якщо з групою OH сусідять атоми металічних елементів у нижчих ступенях окиснення +1, +2, то такі гідроксиди є основами.
• Якщо в гідроксидах атоми металічних елементів у ступені окиснення +3, +4 (рідше +2), то це амфотерні гідроксиди.
* Якщо з цією групою з’єднані неметалічні елементи, то отримані речовини називають кислотами. Кислоти можуть утворювати й деякі металічні елементи в ступенях окиснення +5, +6, +7.
Як же відрізнити їхні формули? В основ прийнято записувати спочатку символ металічного елемента, а потім гідроксильні групи — NaOH, а в кислот слід записувати спочатку символ атома Гідрогену, а потім усе інше — HNO3 (це «інше» називають кислотним залишком).
КИСЛОТИ
Визначення й формули кислот
Кислоти — складні речовини, до складу яких входять атоми Гідрогену й кислотний залишок.
Кислотний залишок може бути різним:

Якщо в кислотному залишку немає Оксигену, то кислота не належить до гідроксидів, тому що неможливо виділити гідроксильну групу, наприклад НС1. Але це, звичайно, теж кислота.
— Спробуй знайти формули кислот: H2S, Zn(OH)2, MgCO3, H3PO1, Cu(OH)2, НС1, H2SO1.
— Треба знайти формули, де на першому місці стоїть Н. Це H2S, НС1.
— А ще? Не обов’язково має бути два елементи, може бути й три. Наприклад, H3PO1.
— Тоді й H2SO1.
— Правильно. Здається, ми вибрали всі потрібні формули!
Назви кислот
Назви кислот походять від назви того елемента, який утворює кислоту.
Ось тут насамперед слід ураховувати, є в складі кислоти Окси-ген чи ні. Якщо Оксигену немає, то в назві має бути суфікс -ид-(-ід-). Це ж бінарна сполука. Наприклад, кислота HCl містить Хлор, Оксигену немає, назва — хлоридна кислота. Кислота H2S має назву сульфідна кислота, HBr — бромідна кислота. Як бачите, до назви входить і, власне, слово «кислота».
Якщо в складі кислоти є Оксиген, то суфікс буде -am- (якщо ступінь кислототвірного елемента вищий, Оксигену в складі більше) або -іт- (якщо ступінь окиснення кислототвірного елемента менший, Оксигену в складі менше).
Приклад. H2SO1 — сульфатна кислота, H2SO3 — сульфітна кислота.
Завдання. Визначте ступені окиснення Сульфуру в H2SO1 і H2SO3.
Для утворення назв кислот використовують також інші суфікси, про них ми будемо говорити пізніше.
Префікси орто- й мета- використовують для позначення кислот, які утворені елементом з однаковим ступенем окиснення, але відрізняються кількістю атомів Гідрогену й Оксигену: якщо їх більше — орто, менше — мета. Наприклад: H3PO4 — ортофос-фатна кислота, HPO3 — метафосфатна кислота.
Приклад. Назвіть кислоти: б
Завдання
1. Визначте ступені окиснення Фосфору в H3PO1
і HPO3. Подумайте, чому в них однакові суфікси.
2. Назвіть кислоти:
H2SiO3, H2CO3.
HNO3, HNO2, HI, HF. Щ
Розв'язання. Формули перших двох кислот містять Оксиген. Отже, суфікси в назвах будуть -іт або -am-. У кислотах HNO3 і HNO2 кислототвірний елемент — Нітроген. У сполуці HNO3 він має вищий ступінь окиснення +5 (і Оксигену там більше), тому її назва — нітратна кислота. У сполуці HNO2 ступінь окиснення Нітрогену +3 (і Оксигену менше), відповідно, її назва — нітритна кислота. Інші дві кислоти безоксигенові, отже, назви містять суфікси -идНІ — йодидна,
HF — флуоридна кислота.
Складання формул кислот і визначення сумарного ступеня окиснення кислотного залишку
Дуже важливо вміти визначати сумарний ступінь окиснення кислотного залишку. Без цього неможливо буде складати формули солей. Сумарний ступінь окиснення кислотного залишку визначити легко. Виходимо з того, що Гідроген має ступінь окиснення 4-1. Тоді ступінь окиснення кислотного залишку дорівнюватиме числу атомів Гідрогену зі знаком «-».
Наприклад:
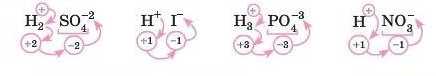
Завдання
Визначте сумарний ступінь окиснення кислотного залишку в кислотах: H3PO1,
HNO3,
H2S,
НС1.
Приклад
Складіть формули кислот за наведеними кислотними залишками:
SOi2, SiOi2, Br-, S-2. Розв’язання. Дописуємо попереду атом Гідрогену й ставимо біля нього індекс, що дорівнює сумарному ступеню окиснення кислотного залишку:
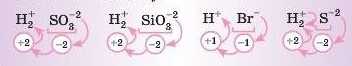
Тепер можна скласти загальну формулу кислот, позначивши умовно кислотний залишок літерою А — аніон:
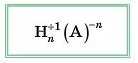
Класифікація кислот
Кислоти класифікують за їхнім складом, зокрема, за наявністю атомів Оксигену (табл. 9).
Таблиця 9
Класифікація кислот за складом
|
Окснгеновмісні кислоти |
Безоксигенові кислоти |
|
H2SO1 сульфатна |
HF флуоридна (плавикова) |
|
H2SO3 сульфітна |
HCl хлоридна (соляна) |
|
HNO3 нітратна |
HBr бромідна |
|
H3PO1 ортофосфатна |
НІ йодидна |
|
H2SiO3 силікатна |
H2S сульфідна |
За кількістю атомів Гідрогену, здатних під час хімічних реакцій заміщуватися на метал, усі кислоти ділять на одноосновні (з одним атомом Н), двохосновні (з двома атомами Н) і трьохосновні (з трьома атомами Н) (табл. 10).
Таблиця 10
Класифікація кислот за числом атомів Гідрогену
|
Кислоти |
||
|
Одноосновні |
Двохосновні |
Трьохосновні |
|
HNO3 нітратна |
H2SO4 сульфатна |
H3PO1 ортофосфатна |
|
HF флуоридна |
H2SO3 сульфітна |
H3BO3 боратна |
|
HCl хлоридна |
H2S сульфідна |
|
|
HBr бромідна |
H2CO3 карбонатна |
|
|
НІйодидна |
H2SiO3 силікатна |
|
ДІЗНАЙТЕСЯ БІЛЬШЕ
Термін «одноосновна кислота» виник тому, що для взаємодії з однією молекулою такої кислоти потрібна «одна основа», наприклад NaOH або KOH:
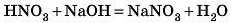
Двохосновна кислота вимагає для своєї нейтралізації вже «дві основи», а трьохосновна — «три основи»:
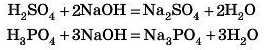
Найбільш поширені одно-, дво- та трьохосновні кислоти, однак у природі трапляються кислоти з більшої основністю, наприклад чотири, п’ять або навіть сім.
Дво-, три- й більше основні кислоти належать до багатооснов-ІІИХ кислот.
ОСНОВИ Й АМФОТЕРНІ ГІДРОКСИДИ Визначення й формули основ
Основи — складні речовини, до складу яких входять катіони металу й аніони гідроксильної групи OH-.
Наприклад: КОН, Ca(OH)2.
— Розпізнавати основи — легко! Не заважай мені, я сам!
— От дивися, формули NaOH, НС1, H2SO1, Ca(OH)2, HBr, Cu(OH)2, H3PO1, H2SiO3, H2S, Fe(OH)3.
— Я зараз дуже легко виберу з них кислоти — я їх уже знаю — і основи. Зараз зосереджуся: кислоти — починаються з Н. Значить, це HCl,
H2SO1, HBr, H3PO1, H2SiO3, H2S.
— Жодної помилки! А ось формули основ: NaOH, Ca(OH)2, Cu(OH)2, Fe(OH)3. Я відразу помічаю групу ОН!
Назви основ
У назвах основ використовують слово «гідроксид». Назву утворюють таким чином: спочатку пишуть або вимовляють назву металічного елемента, який входить до цієї основи, а потім додають слово «гідроксид»: NaOH — натрій гідроксид. Відмінюють тільки слово «гідроксид», наприклад: «Долити кислоту до натрій гідроксиду».
Якщо металічний елемент має змінний ступінь окиснення, то його вказують римськими цифрами в дужках: Fe(OH)3 — ферум(ІІІ) гідроксид.
Традиційно римськими цифрами в назві сполук позначають валентність. Однак зараз римські цифри використовують і для позначення ступеня окиснення.
Складання формул основ, визначення ступеня окиснення металічного елемента
Оскільки гідроксильні групи мають сумарний ступінь окиснення -I (о 2H41) , то формулу основи легко скласти, знаючи ступінь окиснення металу. До хімічного символу металу треба приписати таку кількість гідроксигруп, яка дорівнює його ступеню окиснення.

Давайте потренуємося й напишемо формули: калій гідроксид, кальцій гідроксид, ферум(ІІІ) гідроксид.
Спочатку пишемо символ металічного елемента і його ступінь окиснення, потім — гідроксильні групи, пам’ятаючи про те, що в них ступінь окиснення -1.
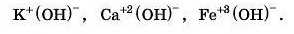
Число гідроксигруп буде дорівнювати ступеню окиснення металічного елемента. Отже, формули: 13
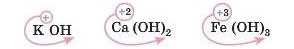
За числом гідроксильних груп легко визначити ступінь окиснен-ня металічного елемента: якщо в гідроксильної групи ступінь окис-нення дорівнює -1, то число цих груп буде дорівнювати ступеню окиснення металу: Fe(OH)8 — утворений Fe'3, a Fe(OH)2 — Fe'2.
— От у назві «ферум(ІІІ) _ учора мій
гідроксид» цифра III - однокласник
не число атомів Феруму, написав Fe3OH!
а його ступінь окиснення! Це ж неправильно!
Приклад. Визначте ступені окиснення металічних елементів у гідроксидах: Mg(OH)2, LiOH, Al(OH)3.
Розв'язання. Поставимо ступінь окиснення над гідро-ксигрупою. Потім, виходячи з умови електронейтральності, визначимо, яким є ступінь окиснення металічного елемента:
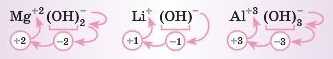
Складемо загальну формулу основ:
Класифікація основ
1. За розчинністю у воді
Основи бувають розчинними й нерозчинними.
Розчинні основи називають лугами. Вони утворені лужними (ІА підгрупа) і лужноземельними (ІІА підгрупа — Ca, Sr, Ba) металами.
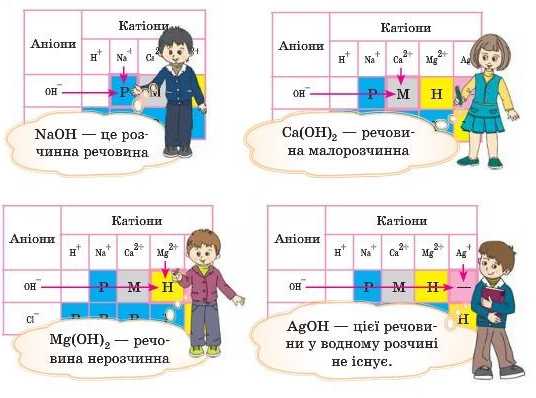
Уточнити, розчинною є сполука чи ні, ми завжди можемо, зазирнувши в таблицю розчинності. Якщо на перетині рядків OH- і стовпчика із символом катіона металу стоїть літера «Р» — сполука розчинна, «Н» — нерозчинна, «М» — малорозчинна, «-» — не існує у водному розчині {див. форзац).
2. За числом гідроксильних груп
Кількість гідроксильних груп у складі основ визначає їхню кислотність.
NaOH — однокислотна основа.
Cu(OH)2 — двокислотна основа.
Fe(OH)3 — трикислотна основа.
ДІЗНАЙТЕСЯ БІЛЬШЕ
Однокислотні основи реагують з однією молекулою однооснов-ної кислоти:
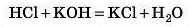
Двокислотні основи реагують із двома молекулами однооснов-иої кислоти або з однією молекулою двохосновної:
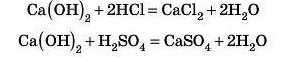
Якщо груп OH дві або більше, то сполуки відносять до багато-кислотних основ.
Амфотерні гідроксиди
Амфотерні гідроксиди — це складні речовини, які складаються з атомів металічного елемента й гідроксильних груп.
Формули амфотерних гідроксидів виглядають так само, як і основ: Al (OH)3 , Zn(OH)2. Назви утворюються так само, яків основ. Al(OH)3 — алюміній гідроксид.
Zn(OH)2 — цинк(ІІ) гідроксид.
Вони відрізнятимуться від основ хімічними властивостями. Але про це пізніше.
Отже, ми тепер знаємо:
ПЕРЕВІРТЕ СВОЇ ЗНАННЯ
1. Закінчіть речення:
а) Гідроксидами називають речовини...
б) Формули основ складаються з...
в) У формулах кислот розрізняють...
г) Стишені окислення металічного елемента в основах..., в амфотерних гідроксидах...
2. Чи можуть металічні елементи утворювати кислоти? В якому випадку?
3. Які типи класифікації кислот ви знаєте? Наведіть приклади.
4. Як класифікують основи? Наведіть приклади.
5. Як називають розчинні основи?
ВИКОНАЙТЕ ЗАВДАННЯ
1. Складіть формули безоксигенових кислот, до складу яких входять атоми галогенів. Назвіть їх.
2. Складіть формули гідроксидів лужних металів, назвіть їх.
3. Визначте сумарний ступінь окиснення кислотного залишку в кислотах: H2S, H3PO4, HNO3, H2SiO3, НІ. Назвіть ці кислоти. Класифікуйте їх за кількістю атомів Гідрогену.
4. Складіть формули кислот за кислотними залишками: Cl , ClO4, SO4 , Br , BO3 , S2 . Класифікуйте їх за наявністю атомів Оксигену.
δ. Напишіть формули основ і амфотерних гідроксидів, утворених такими металічними елементами: Алюміній, Кальцій, Калій, Цезій, Стронцій, Цинк(ІІ), Кобальт(ІІ), Магній, Хром(ІІІ). Класифікуйте їх за числом гідроксильних груп.
6. Із наведених речовин випишіть окремо формули кислот і основ, амфотерних гідроксидів: КОН, H2SO3, Ba(OH)2, HBr, Ni(OH)2, H3PO4, HNO3, LiOH, Al(OH)a. Дайте їм назви.
7. Скільки моль атомів кожного елемента міститься в 3 моль сульфатної кислоти?
8. Скільки моль ферум(ІІІ) оксиду містить стільки ж гідроксильних груп, скільки 9 моль натрій гідроксиду?
9. Обчисліть масу алюміній оксиду, який утворюється внаслідок узаємодії 0,8 моль алюмінію з киснем.
Це матеріал з підручника Хімія 8 клас Гранкіна
Автор: admin от 21-09-2016, 00:11, Переглядів: 3336