§ 15. Закон Гей-Люссака. Закон Авогадро. Молярний об'єм газів
ЗАКОН ГЕЙ-ЛЮССАКА
Важливим внеском у встановленні й розумінні такої величини, як моль, стали роботи хіміків із газами. Загалом саме вивчення газів підштовхнуло хіміків до математичних розрахунків. Так, на початку XIX століття Жозеф-Луї Гей-Люссак, ґрунтуючись на численних експериментах, сформулював закон об’ємних відношень:
Об’єми газів, що вступають у реакцію, за однакових умов відносяться один до одного як прості цілі числа.
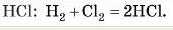
Практично об’єми газів, що реагують, відносяться як коефіцієнти в рівнянні реакції. Наприклад, під час утворення гідроген хлориду в реакцію вступає один об’єм водню й один об’єм хлору; у результаті утворюються 2 об'єми
Цим законом дуже зручно користуватися під час розв’язування задач, але тільки в тому випадку, якщо об’єми всіх газів, що беруть участь у реакції, виміряні за однакових умов.
ЗАКОН АВОГАДРО
1811 р. Амедсо Авогадро, ретельно проаналізувавши результати експериментів Гей-Люссака й інших учених, дійшов висновку, що закон об’ємних відношень дозволяє зрозуміти, як же «влаштовані» молекули газів. «Перша гіпотеза, — писав він, — яка виникає у зв’язку із ним і є єдино прийнятною, полягає у припущенні, що сумарна кількість молекул будь-якого газу завжди одне й те саме в одному й тому самому об’ємі...» Ще три роки йому знадобилося, щоби чітко сформулювати свій закон:
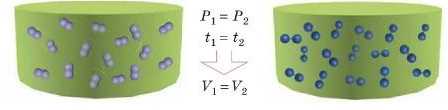
В однакових об’ємах різних газів за однакових умов міститься однакове число молекул.
Під однаковими умовами тут мають на увазі тиск і температуру. Із курсу фізики ви знаєте, що гази залежно від температури змінюють свій об’єм, і до того ж вони стискаються: в разі збільшення тиску об’єм газів зменшується.
Уявіть, наприклад,
2 трилітрові банки це однакові об’єми, в одній банці водень, в іншій кисень, тобто різні гази. Обидві банки стоять поряд у кімнаті однакові умови. Отож, у них міститься однакове число молекул газів O2 і H2.
Гази підпорядковані закону Авогадро, а тверді й рідкі речовини — ні. Це пояснюється тим, іцо в газах відстань між молекулами значно більша, ніж розміри самих молекул. Тому об’єм газу визначається в основному відстанню між молекулами.
За однакового тиску й однакової температури відстань між молекулами для різних газів приблизно однакова. Тому однакова кількість молекул різних газів за однакових умов займає приблизно однаковий об’єм.
За високого тиску або низької температури відстань між молекулами газів зменшується і стає близькою до розмірів самих молекул. Тому гази за низьких температур і високих тисків не підпорядковані закону Авогадро.
• Як ви гадаєте, яке повітря легше сухе або вологе? Вибрали відповідь? (Відповідь 1 дивісться наприкінці параграфа.)
НАСЛІДКИ ІЗ ЗАКОНУ АВОГАДРО
Перший наслідок. Молярний об'єм газів
Уважно стежимо за міркуванням:
За однакового тиску й температури гази займають однаковий об’єм, і в цьому об’ємі міститься однакова кількість молекул. Але одиниця вимірювання кількості молекул моль. Виходить, за однакових умов в однакових об’ємах міститься однакова кількість молів речовини.
А в якому об’ємі міститься 1 моль молекул? Це легко обчислити, зважуючи гази. Візьмемо по 1 моль декількох різних газів. Якщо взяти для експерименту 28 г азоту (маса 1 моль N2), 32 г кисню (маса 1 моль O2), 44 г карбон(1\г) оксиду (маса 1 моль CO2) і виміряти об’єми цих газів за однакових тиску й температури, наприклад за тиску 101,3 кГІа й температури 273К, то виявиться, що всі вони займають однаковий об’єм 22,4 л. Ось так і робили вчені.
До речі, тиск 101,3 кГІа й температуру 273 K називають норма льішми умовами, або скорочено н. у.
Підсумок наших міркувань:
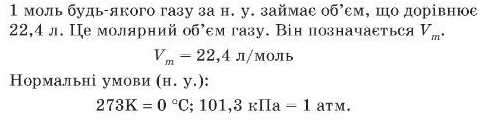
Можна обчислити об’єм 1 моль газу виходячи з густини газу.
Приклад. Обчислимо об’єм, який займає за н. у., наприклад, водень. Густина (р) водню за цих умов дорівнює 0,09 г/л. Згадаємо, що густина — це відношення маси до об’єму:
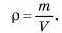
Якщо йдеться про 1 моль, то маса буде дорівнювати молярній масі, а об’єм — молярному об’єму, тоді:
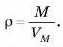
Звідси молярний об’єм визначається відношенням молярної маси речовини до її густини:
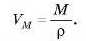
Підставимо у формулу чисельні значення для водню, з урахуванням M(H2) = 2 г/моль:
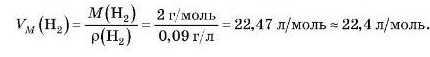
Такі самі розрахунки можна провести й для інших газів. Отриманий молярний об’єм буде дещо відрізнятися, але для приблизних розрахунків цілком можна використовувати величину 22,4 л/моль.
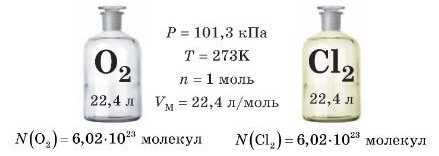
— (>т якщо в нас є ЗО л газу, треба
надути ним кульки. Об’єм 1 кульки 3 л. Годі ми можемо надути ЗО
— = 10 кульок.
З
Так само і з молями.
Якщо ми знаємо, який об’єм займає газ за н. у., то можна обчислити число молів:
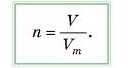
Молярний об’єм V111 можна визначити як відношення об’єму газу до його кількості речовини:
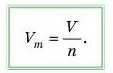
Звідси
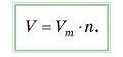
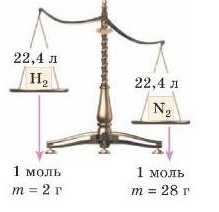
Урахуйте, що за однакового об’єму маси газів будуть різними.
• Учень на уроці хімії сказав, що 1 моль води за н. у. займає об’єм 22,4 л. Це правильна відповідь? Яку оцінку ви б йому поставили? {Відповідь 2 дивіться накінці параграфа.)
Під час розв’язування задач завжди слід ураховувати агрегатний стан речовини за певних умов і пам’ятати, що закон Аво-гадро — для газів!
Запам’ятайте цю схему, вона допоможе вам розрахувати кількість речовини, число структурних одиниць, масу й об’єм речовини. Зверніть увагу, що, знаючи кількість речовини, ми легко можемо обчислити масу, об'єм і число частинок цієї речовини.
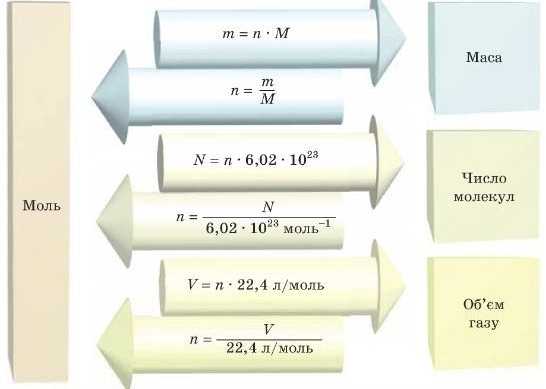
Випишемо формули, в яких використовується кількість речовини (моль), і запам’ятаємо їх:

ВІДПОВІДІ ДО ЗАВДАНЬ ПАРАГРАФА
Відповідь 1. Візьмемо однакові об’єми сухого й вологого повітря. Припустимо, що повітря складається тільки з азоту (4/5 частини) і кисню (1 /5 частина).

Згідно із законом Лвогадро, число молекул газів у однакових об’ємах однакове, тому, якщо повітря буде вологим, замість більш важких молекул азоту або кисню в повітрі з’являться легші молекули води (порівняйте молярні маси).
Виходить, що вологе повітря легше. Ви відповіли правильно. І підтвердження цьому факту ми можемо спостерігати в природі: більш вологе повітря, як більш легке, піднімається вгору, у верхніх шарах атмосфери охолоджується, вода конденсується в краплі. І ми спостерігаємо хмари, з яких може йти дощ. Це і є зв’язок атмосферних явищ із законом Авогадро.
Відповідь 2. Якщо відповідь «так, правильна», це значить, що ви погано подумали й не врахували всі чинники. Нормальні умови це температура 0 °С, а за цієї температури вода може бути в рідкому або твердому стані це ж температура танення льоду. Безсумнівно, скільки-небудь води в газовому стані за н. у. (і навіть коли мороз) в атмосфері є. Але в задачі маються на увазі певна маса й об’єм води, наприклад, у склянці, яка рантом уся стала газом за н. у. Звичайно, це неможливо.
Об’єм 1 моль води (рідкої) можна обчислити. Для цього слід скористатися поняттям густини (р). Із курсу фізики ви знаєте, що

ПЕРЕВІРТЕ СВОЇ ЗНАННЯ
1. Сформулюйте закон Авогадро. \
2. (’формулюйте перший наслідок із закону Авогадро.
3. Назвіть параметри, які відповідають нормальним умовам.
4. ІЦо таке молярний об’єм газу?
5. В яких одиницях виражають молярний об’єм газу?
ВИКОНАЙТЕ ЗАВДАННЯ
1. Підчас повного згоряння суміші, яка складається з одного об’єму певного газу та двох об’ємів кисню, утворився один об’єм вуглекислого газу та два об’єми водяної пари. Визначте формулу газу.
Підказка: спочатку запишіть рівняння реакцій. Відповідно до закону Гей-Люссака, об’єми газів співпадають з коефіцієнтами в рівняннях. Тому перед невідомим газом ставимо коефіцієнт 1, перед O2 — 2 , також, відповідно, перед CO2 — I, H2O 2. Рівняння зрівняно. Тому кількість атомів елементів ліворуч дорівнює кількості атомів праворуч. Поміркуйте, які атоми і в якій кількості входять до складу молекулі невідомого газу. Ця підказка допоможе вам і під час розв’язання задач 2 і 3.
2. Після вибуху суміші, яка складається з одного об’єму досліджуваного газу й одного об’єму водню, утворився один об’єм водяної пари та один об’єм азоту. Усі вимірювання проводили за однакових умов. Визначте формулу досліджуваного газу.
3. Певний газ горить у хлорі, утворюючи азот і хлороводень, причому об’єми хлору, luo увійшов у реакцію, та азоту, що утворився, відносяться як 3:1. Визначте молекулярну формулу цього газу.
НАВЧАЄМОСЬ РОЗВ'ЯЗУВАТИ ЗАДАЧІ
Користуючись прикладами, розв’яжіть задачі.
Визначення об'єму газу, якщо відомо його кількість речовини(моль)

1. Визначте, який об’єм займають за н. у.:
а) 0,5 моль карбои(П) оксиду;
б) 3 моль гелію;
в) 1,5 моль кисню.
Відповідь: 11,2 л; 67,2 л; 33,6 л.
2. Який об’єм за н. у. займають 2 моль нітроген(І) оксиду? 2 моль карбоh(TV) оксиду? Поясніть отримані результати.
Відповідь: 44,8 л.
3. Заповніть таблицю.
|
Кількість речовини (моль) |
Об’єм газу (н. у.) |
|
3 моль CO2 |
|
|
5,6 л CH4 |
|
|
0,1 25 моль N2 |
|
|
1 56,8 л SO2 |
Визначення кількості речовини в певному об'ємі газу за н. у.

1. Визначте число молів коленого газу (об’єми дано за н. у.):
а) у 5,6 л кисню;
б) у 10 л водню;
в) у 0,5 л азоту.
Відповідь:
а) 0,25 моль;
б) 0,45 моль;
в) 0,022 моль.
2. У балоні об’ємом 20 л міститься гелій (н. у.). Визначте, якій кількості речовини відповідає цей об’єм.
Відповідь: 0,89 моль.
3. Яка кількість речовини міститься:
а) у 6 г вуглецю;
б) у 44,8 л хлору (н. у.);
в) у 336 і' заліза?
Відповідь: 0,5 моль; 2 моль; 6 моль.
Обчислення маси газу, якщо відомо його об'єм (н. у.)
Приклад.Обчисліть масу 5,6 л азоту (за н. у.).
Розв'язання Спосіб 1
1) Визначимо, яку кількість речовини становить 5,6 л азоту, за формулою:
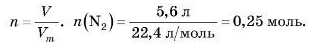
2) Тепер обчислимо масу цієї кількості речовини азоту за формулою:

Спочатку рахуємо молярну масу азоту, пам’ятаючи про те, що молекула азоту двохатомна:
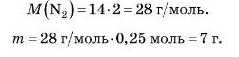
Спосіб 2
Цю задачу також можна розв'язати, об'єднавши формули
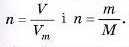
Це можна зробити, тому що в обох формулах
кількість речовини η V цьому випадку однакова, а якщо однакові
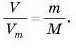
ліві частини рівняння, то однакові й праві частини:
Підставимо дані задачі в це рівняння:
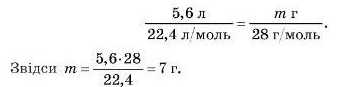
Відповідь: маса 5,6 л азоту становить 7 г.
1. Обчисліть, яку масу становлять за н. у. такі об’єми газів:
а) 48 л водню;
б) 95 л фтору;
в) 100 л сульфуp(IV) оксиду.
Відповідь: 4,3 г; 101,10 г; 285,7 г.
2. Визначте масу 11,2 л гідрогенсульфіду H2S за н. у.
Відповідь: 1 7 г.
3. Чи однакові маси й об’єми (за однакових умов) мають 1,5 моль CO2 і 1,5 моль O2? Чому?
Відповідь: об’єми однакові, маси ні.
Визначення об'єму газу (н. у.), якщо відомо його масу
Приклад. Який об’єм займають 10 г кисню за н. у.?
Розв'язання Спосіб 1
1) Визначимо, яку кількість речовини становлять 10 г кисню.
за формулою:
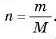
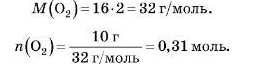
2) Обчислимо об’єм цієї маси кисню за формулою:
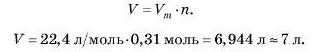
Спосіб 2
Розв’яжемо цю задачу іншим способом, об’єднавши формули, які були використані:
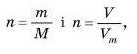
одержавши
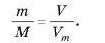
Підставимо дані задачі, прийнявши шуканий об’єм за х:
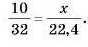
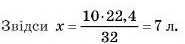
Відповідь:10 г кисню за н. у. займають об’єм 7 л.
1. Обчисліть об’єм, який займатимуть за н. у.:
а) 10г водню;
б) 10 г карбон(ІУ) оксиду;
в) 10 г мотану CII4.
Поясніть отриманий результат.
Відповідь: а) 112 л; б) 5 л; в) 1Ί л.
2. Який газ займатиме більший об'єм за н. у.: 20 г водню або 40 г карбон(ІУ) оксиду? Розв’яжіть задачу усно.
Визначення об'єму газу, якщо відомо число його молекул
Приклад. Який об’єм займають ,S-IOx'10 молекул карбон(ІУ) оксиду за н. у.?
Розв'язання Спосіб J
1) Спочатку знайдемо, яку кількість речовини становить це число молекул, за формулою:

2) Тепер обчислимо об’єм цієї кількості речовини за формулою:
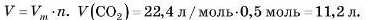

Розв'язання задач, у яких дано суміші газів


1. Газова суміш складається із 2,24 л кисню й 3,36 л сульфур(УІ) оксиду. Об’єми газів доведено до нормальних умов. Обчисліть масу суміші.
Відповідь: 15,2 г.
2. Визначте об’єм, який займе за нормальних умов газова суміш, що містить водень масою 1,4 г і азот масою 5,6 г.
Відповідь: 20,16 л.
ДОДАТКОВІ ЗАВДАННЯ
1. Дайте визначення поняття «молярний об’єм». Як можна його обчислити?
2. Густина азоту за н. у. дорівнює 1,2505 г/л, водню 0,08988 г/л, вуглекислого газу — 1,9769 г/л, гелію 0,17846 г/л, кисшо 1,42895 г/л. Який із цих газів найлегший? найважчий? Обчисліть молярний об’єм цих газів за н. у. та їхні молярні маси. Чи можна за значенням а) молярного об’єму й б) молярної маси визначити найлегший і найважчий гази?
3. Чому гази за н. у. мають однакове значення молярного об’єму, але різні значення молярної маси?
4. Ba якими формулами можна обчислити маси й об’єми газів за н. у.?
5. Є дві колби однакового об’єму, які містять озон і кисень за однакових умов. Не виконуючи розрахунків, визначте чи однакову масу матимуть ці колби з газами. Чи буде однаковим число моль?
6. Обчисліть маси й об’єми (н. у.) зразків водню й кисню кількістю речовини по 1 моль. Який зразок:
а) містить більше молекул, в) має більший об’єм,
б) містить більше атомів, г) має більшу масу?
Дайте відповідь на питання, не виконуючи математичних розрахунків, а тільки розмірковуючи логічно.
7. Чадний газ кількістю речовини 0,5 моль чи 1 моль матиме більшу масу й більший об’єм? Дайте відповідь, не виконуючи математичних розрахунків, а тільки розмірковуючи логічно.
8. Кисень кількістю речовини 0,5 моль або об’ємом 22,4 л (и. у.) матиме більшу масу? Задачу розв’язати усно.
9. Які гази будуть займати найбільший і найменший об’єми:
а) кисень кількістю речовини 2 моль;
б) кисень об’ємом 22,4 л (н. у.);
в) кисень масою 16 г?
Задачу розв’язати усно.
10. Визначте, який об’єм за н. у. займають такі порції кисню:
а) 2 моль;
б) 18,06· IO2' молекул;
в) 18,06· IO23 атомів Оксигену;
г) 32 г?
11. Яку масу має кисень об'ємом 112 л (н. у.)? Чи матиме таку масу озон такого самого об’єму? Якщо ні, обчисліть масу озону.
12. На терези помістили дві однакові колби й урівноважили їх. В одну колбу помістили 0,025 моль гелію. Яким об’ємом водню (н. у.) треба заповнити другу колбу, щоб рівновага не порушилася?
13. Де міститься більше молекул:
а) вуглекислий газ об’ємом 44,8 л (н. у.);
б) вуглекислий газ масою 44 г;
в) сульфур(ІУ) оксид кількістю речовини 1 моль;
г) сульфур(ІУ) оксид масою 32 г?
14. *Маса суміші оксидів Карбону дорівнює 44 г, об’єм суміші — 28 л (и. у.). Скільки молекул CO2 у суміші припадає на 1 молекулу CO?
Це матеріал з підручника Хімія 8 клас Гранкіна
Автор: admin от 21-09-2016, 00:08, Переглядів: 5181