§ 11. Ступінь окиснення
— Як складати формули речовин, писати рівняння реакцій для сполук із йонним зв'язком?
Для цього нам потрібно нове поняття ступінь окиснення.
ПОНЯТТЯ ПРО СТУПІНЬ ОКИСНЕННЯ
Ступінь окиснення — умовний заряд, обчислений із припущення, що всі зв’язки в речовині — йонні, тобто один атом повністю віддав електрони іншому атому.
Зверніть увагу, що це умовний заряд, тобто це не зовсім правда. Так, так, у хімії іноді доводиться трохи брехати... Використовуючи ступінь окиснення, ми для зручності припускаємо, що всі частинки у сполуці (навіть якщо в ній зв’язки ковалентні) є йонами.
Що вам потрібно знати про ступінь окиснення?
Ступінь окиснення...
• ...позначається арабськими цифрами зі знаком « + » або « » перед цифрою. Цифру 1 зазвичай не пишуть. У формулах ступінь окиснення записують над хімічним символом елемента. Наприклад, Na2S2;
• ...Флуору завжди дорівнює 1;
• ...Оксигену в сполуках дорівнює 2 (крім сполук із Флуором, де він дорівнює 4-2 або fi, наприклад F21O 2, і нероксидів, де він дорівнює 1, наприклад H21O21);
• ...Гідрогену в сполуках дорівнює +1 (крім гідридів металів, де він дорівнює 1, наприклад Cal2H21);
• ...у простих речовинах і в сполуках з ковалентним неполярним зв’язком ступінь окиснення дорівнює нулю (наприклад, H1', О1’, Na0);
• ...одноатомного йона дорівнює його заряду. Наприклад, у натрій хлориді ступінь окисіїення Натрію дорівнює +1, а Хлору — 1;
• ...якщо в складі йона 2 або більше атомів елементів, його заряд дорівнює алгебраїчній сумі зарядів цих елементів. Наприклад,
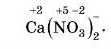
Найголовніше: алгебраїчна сума ступенів окиснсння всіх елементів у сполуці завжди дорівнює нулю.
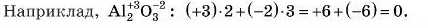
Заряди йонів записують над хімічними символами, причому першою слід писати цифру, а потім знак « + » або «-». Зверніть увагу, що ступінь окиснешія записують так: спочатку знак, а потім цифра. Наприклад, ступінь окиснешія S-2, а запис йона — S2 .
Як ви вже, напевно, помітили, дуже часто ступінь окиснсння чисельно дорівнює валентності, тому що також залежить від числа валентних електронів на зовнішньому рівні.
Ступінь окиснсння, як і валентність, може бути змінною. Її вказують, як і валентність, римськими цифрами в дужках: ферум(ІІІ) оксид.
Зазвичай у формулах на першому місці пишуть символ елемента з позитивним ступенем окиснсння, а на другому — з негативним.
ХІМІЧНІ ФОРМУЛИ І СТУПЕНІ ОКИСНЕННЯ
Складаємо формули за ступенями окиснення
Скласти формули сполук за ступенями окиснення легко, майже так само, як і за валентністю. Під час складання формул слід ураховувати електронегативність: більш електронегативні елементи «забирають» електрони, менш електронегативні «віддають» їх.
Як написати, наприклад, формулу калій броміду?
У цій сполуці Калій віддає 1 електрон (більше на зовнішньому рівні електронів у нього немає, він у І групі) і перетворюється на
йон K . Бром може прийняти тільки 1 електрон — у нього на зовнішньому рівні вже с 7 електронів. До завершення рівня (октету електронів) йому не вистачає тільки 1 електрона, і він стає йоном Br".

— З урахуванням ступенів окионення, до речі, стає зрозумілим, чому слід писати KBr, а не K7Br (як вважають деякі учні, думаючи, що Калій одновалентний, а Бром семи валентни й).
Сумарний заряд дорівнює 0. Звідси й формула — KBr.
Приклад
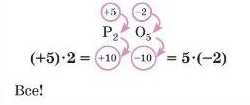
Складіть формулу фосфор(У) оксиду.
1. Записуємо символи елементів: PO.
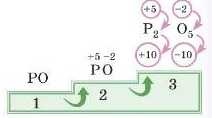
Оскільки в Оксигену елсктроиегативність більше, він буде «забирати» 2 електрони (яких бракує йому до завершення рівня) в атома Фосфору, ступінь окис-иення дорівнюватиме 2. Фосфор, згідно з умовою (в умові написано Фосфор(У)), буде «віддавати»
5 електронів (прагнучи одержати завершений зовнішній рівень), ступінь окиснення дорівнюватиме +5.
2. Записуємо ступені окиснення над символами хімічних елементів:
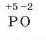
3. Оскільки алгебраїчна сума ступенів окиснення в сполуці завжди дорівнює нулю, підбираємо потрібні індекси:
Завдання
Напишіть форму- ·> ли таких сполук з урахуванням ступеня окиснення та елек-тронсгативність елемен-тів: фосфор(У) хлориду, силіцій(ІУ) флуориду, селен гідриду.
— Якщо в одного елемента ступінь окиснення парний, а в іншого непарний, можна скористатися «правилом для двієчників і*: значення ступенів окиснення потрібно поставити навхрест індексами. Якщо ступені окиснення парні, то нічого не вийде, бо треба знати хоча б таблицю множення на 2.
Обчислюємо ступені окиснення за формулами
Ступені окиснення в бінарній сполуці обчислюють так:
1. Записуємо формулу, наприклад, NO2.
Записуємо ступінь окиснення Оксигену, він майже завжди дорівнює -2.
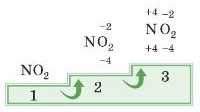
2. У сполуці 2 атоми Оксигену, отже, сумарний заряд дорівнює 2(-2) = -4.
3. Так, оскільки сума ступенів окиснення дорівнює 0, ступінь окислення Нітрогену дорівнюватиме +4.
Як можна обчислити ступінь окиснення в трьохелементній сполуці?
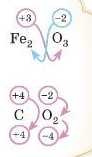
Подумайте трошки самі. Наприклад, визпачте ступінь окиснеп-ня всіх елементів у натрій сульфаті Na2SO.,. Якщо придумали звірте ваше рішення з нашим, якщо не знаєте як — давайте робити це завдання разом.
Записуємо ступені окиснення тих елементів, у яких вони постійні (наприклад, у Натрію ступінь окиснення завжди 11), і тих елементів, у яких вони змінюються тільки у виняткових випадках (наприклад, Оксиген, який у більшості випадків має ступінь окиснення 2).
Оскільки в цьому випадку електронегативність найвища в Оксигену, то інші елементи Натрій і Сульфур будуть мати позитивний ступінь окиснення. Розрахуємо сумарний негативний заряд: 4 атоми Оксигену зі ступенем окиснення -2, отже, разом -8.
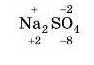
Як можна обчислити ступінь окиенення, якщо у формулі є дужки?
Тепер обчислимо позитивний заряд: 2 атоми Натрію зі ступенем окисиенпя * 1, тобто всього +2. Для того, щоби сума позитивних і негативних зарядів дорівнювала 0, потрібно ще шість позитивних зарядів, які припадають на атом Сульфуру.
Отже, ступінь окиенення атома Сульфуру дорівнює
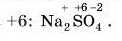
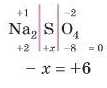
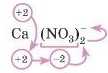
Наприклад, Ca(NO11).,. Знову спробуйте розібратися самостійно. Не виходить? Працюємо разом.
У Кальцію ступінь окиенення постійний і дорівнює +2. У сполуці дві групи (NO3), щоби кількість - і 4- була однаковою, заряд кожної групи має бути 1.
Розберемося зі ступенями окиенення всередині дужок.

Ступінь окиенення Оксигену -2. Оскільки у формулі 3 атоми Оксигену, то їх загальний заряд 3-(-2) = -6.
Тепер треба визначити ступінь окиенення Нітрогену. Якщо мінусів усього 6, то ступінь зкиснення Нітрогену має дорівнювати 45, тому що ступінь окиенення всієї групи NO3 дорівнює -1.
Таким чином, сума ступенів окиенення елементів усередині дужки мас дорівнювати заряду складного йона (у цьому випадку [NO3) , а не нулю.
Також важливо запам’ятати, що ступінь окиенення у формулі над символом елемента записують тільки для одного атома:
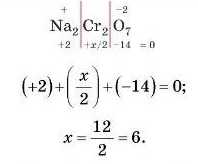
— Я запам’ятав: ступінь окиенення елемента і його індекс в розрахунках треба перем пожити!
Вищий позитивний ступінь окиенення, як і валентність, чисельно дорівнює номеру групи. Найменше значення ступеня окис-нення елемента, яке трапляється в його сполуках, називають нижчим ступенем окиенення.
Інші, якщо вони є, проміжні.
Отже, підіб’ємо підсумок:
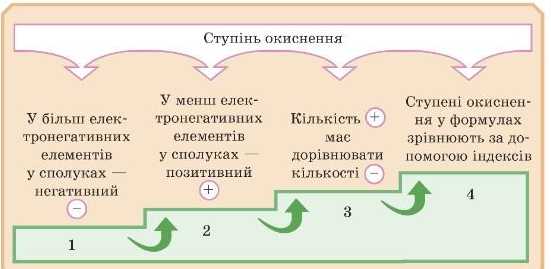
— Я не зрозуміла, навіщо потрібний ступінь окиснення й чим він відрізняється від валентності?
Валентність це число насправді існуючих хімічних ковалентних зв'язків, і вона дорівнює числу иеспарених валентних електронів. Уяви дитячий конструктор: до однієї детальки можна приєднати тільки певне число інших детяльок — стільки, скільки є місць кріплення, наприклад, два або одне.
І вийде молекула. Це стосується речовин з ковалентними зв'язками!
Hy добре. Λ в речовинах з йонними зв'язками?
У йонних сполуках просто електричне притягання між йонами. От уяви, всі детальки конструктора без певних кріплень, просто щільно укладені. Про яку валентність може бути мова? Тоді, щоби правильно писати формули, вчені вигадали ступінь окиснення число відданих або прийнятих електронів. При цьому виявилося, що так зручно складати формули молекул!
— їв речовинах з ковалентним зв'язком?
Так от, поняття ступеня окиснення почали використовувати і для речовин з ковалентним полярним зв'язком. Ллє в цьому випадку під час утворення молекул повної передачі електронів не відбувається. Тому для таких сполук ступінь окиснення рахують умовно!
— Чи завжди ступінь окиснення збігається з валентністю?
— Ні. У речовинах з ковалентним неполярним зв’язком ступінь окиснення дорівнює 0, тому ІЦО ніхто не віддавав і не приймав електрони. Наприклад, H2:
у молекулі один зв’язок — валентність дорівнює І, а ступінь окиснення — 0.
Так, ми розбирали, що в молекулі N2 валентність III* а ступінь окиснення знову 0.
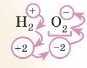
Так, правильно. Ще, наприклад, у пероксидах не збігається. У II2O2 валентність Оксигену — II, а ступінь окиснення — 1. Або нітратна кислота HNOi — порахуй ступінь окиснення у Нітрогену.
— Він дорівнює +5.
— А Нітроген п'ятивалентним не буває! У нього немає п'яти неспарених електронів! А от ступінь окиснення
5 для нього може бути це ж умовний (вигаданий) заряд!
Ox уже ця хімія!
ПЕРЕВІРТЕ СВОЇ ЗНАННЯ
1. ІЦо такс ступінь окиснення?
2. Наведіть приклади сполук, у яких ступінь окиснення елементів та їхня валентність не збігаються. Чому це відбувається?
ВИКОНАЙТЕ ЗАВДАННЯ
1. Визначте ступені окиснення елементів у сполуках:
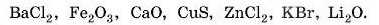
2. Складіть формули речовин, використовуючи значення ступенів окиснення елементів:
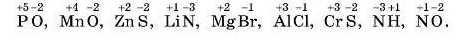
3. Визначте ступені окиснення елементів за формулами:
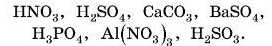
4. Складіть хімічні формули оксидів:
а) Феруму(Н) і Феруму(Ш);
б) Фосфору(111) і Фосфору(V);
в) Сульфуру(ІУ) і Сульфуру(УІ);
г) Мангану(ІІ) і Мангану(УІІ);
д) Карбону(ІІ) і Карбону(ІУ).
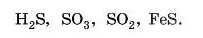
5. Визначте ступінь окиснення й валентність Сульфуру в сполуках:
ДОДАТКОВІ ЗАВДАННЯ
1. Розставте ступені окиснення елементів у сполуках:
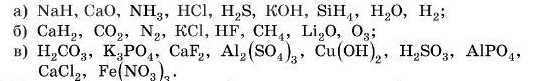
2. У яких сполуках валентність чисельно не дорівнює ступеням окиснення: P4, P2O5, H2, H2O2, O2, H2S, K2O2?
3. Чому не буває валентність 0, але може бути ступінь окиснення, що дорівнює О?
4. Чому не можуть існувати сполуки: SiO3, Be2O3, PO3, S2O7? Поясніть свою точку зору й запишіть правильні формули вищих оксидів цих елементів.
5. В оксидах Оксиген має ступінь окиснення -2. Які бінарні оксигеновмісні сполуки не є оксидами: H2O, SO3, P2O3, CO2, Na2O2, CO, H2O2, BaO, BaO2, OF2?
6. Який мінімальний і максимальний ступені окиснення у Суль-фуру. Силіцію, Нітрогену?
7. Який максимальний ступінь окиснення у Хлору, Брому, Йоду, Астату? Чому для Флуору він не характерний?
8. Складіть формули сполук, не забуваючи про те, що на першому місці у формулі треба ставити символ елемента з меншою електронегативністю, а на другому місці — символ елемента з більшою електронегативністю:
а) нітридів: калій нітриду, кальцій нітриду, алюміній нітриду;
б) хлоридів: натрій хлориду, гідроген хлориду, сульфур(ІУ) хлориду й сульфуP(VT) хлориду;
в) сульфідів: гідроген сульфіду, ферум(ІІ) сульфіду, Kap(X)H(IV) сульфіду, алюміній сульфіду;
г) карбідів: магній карбіду, алюміній карбіду, силіцій(ІУ) карбіду.
9. Напишіть структурні формули сполук: Na2O2, H2O2, BaO, BaO2, OF2, якщо відомо, що всі елементи мають звичайні валентності.
10. Складіть формули бінарних сполук: калій гідриду, алюміній оксиду, гідроген броміду, силіцій(ІУ) гідриду, оксиген флуо-риду, літій йодиду, алюміній силіциду, карбон(ТУ) хлориду, фосфор(У) флуориду, силіцій(ІУ) флуориду.
11. Складіть формули флуоридів Фосфору, де фосфор має ступені окиснення +3, +5, і сульфідів Карбону й Силіцію, де вони мають найвищі ступені окиснення.
12. Допишіть рівняння реакцій, формули продуктів реакцій складіть за ступенями окиснення:

Cj
13. -Невідомий елемент мас на останньому, третьому, енергетичному рівні Л електрони. Про який елемент ідеться? У якій групі, періоді, підгрупі розташований цей елемент? Напишіть формули його вищого оксиду й гідроксиду, що йому відповідає, леткої водневої сполуки, розставте ступені окиснення елементів у цих сполуках.
14. *У невідомого елемента Λ на 2 електрони менше, ніж у йона Флуору. Визначте невідомий елемент Λ і запропонуйте сполуки, утворені цим елементом з ковалентним полярним, ковалентним неполярним і йонним зв’язком.
15. '-Елемент А утворює вищий оксид і летку водневу сполуку, де він має в обох молекулах чисельно однаковий ступінь окиснення, але з різними знаками. Ці дві сполуки за звичайних умов с газами. Про який елемент Λ йдеться? Поясніть, чому задача мас тільки один варіант розв'язання. Напишіть молекулярні та структурні формули цих сполук, визначте тип хімічного зв’язку, вкажіть напрямок, у якому будуть зміщуватися зв’язки в молекулах. Як ці гази розчинятимуться у воді? Поясніть свою точку зору і знайдіть у додатковій літературі або в мережі Інтсрнет довідкові дані на підтвердження (або спростування) вашої думки.
Це матеріал з підручника Хімія 8 клас Гранкіна
Автор: admin от 21-09-2016, 00:01, Переглядів: 3519