§ 10. Йонні зв'язки
— Що буде, якщо різниця електронегативностей елементів, які утворюють хімічну сполуку, дуже велика?
— Як утворюються сполуки, в складі яких є металічні елементи?
Йони
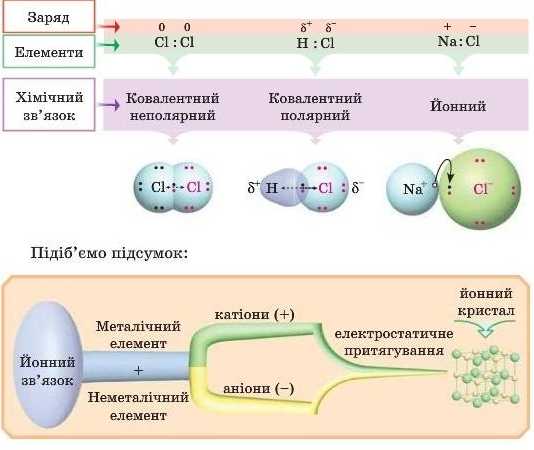
Розглянемо такий випадок: сполуку утворюють атоми Натрію (елемент із низькою електронегативністю — 1,01) і Хлору (елемент із високою електронегативністю — 2,83). У цьому випадку зсув електронної густини від елемента з меншою електронегативністю до елемента з більшою електронегативністю буде майже повним. Вважають, що один атом віддає один електрон, а другий його приймає.
Звернімося до електронно-графічних формул:
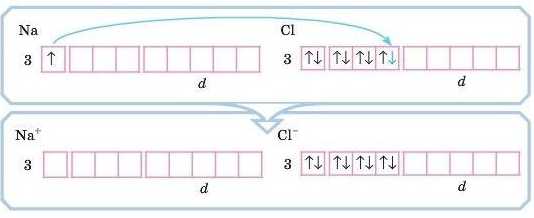
У Натрію електронна конфігурація — ls22s22p63s1, а у Хлору —ls22s22p63s23p°. Очевидно, що Хлору не вистачає одного електрона, щоби завершити свій енергетичний рівень, а в Натрію один електрон «зайвий». Тобто один електрон від атома Натрію перейде до атома Хлору. Атом Хлору, приймаючи електрон, стає негативно зарядженим йолом — аніоном, із зарядом - I: Cl0 + Ie —> Cl-.6

Можна порахувати так: ядро атома Хлору заряджене +17, а електронів у нього стало (17 + 1) = 18.
У сумі: (+17)+(-18) = -1.
Атом Натрію, віддаючи негативно заряджений електрон, стає позитивно зарядженим йоном — катіоном, із зарядом +1:
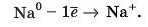
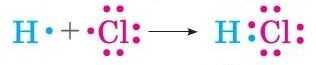
Порахуємо: ядро атома Натрію заряджене +11, а електронів стало 11-1 = 10. У сумі: (+11) + (-10) = +1.
Зверніть увагу, що в обох випадках у йонів буде завершений зовнішній енергетичний рівень (як у інертних газів): у Натрію він буде такий, як у атома Неону (ls22s22p6), у Хлору — як у Аргону (ls22.922p63.$23p6). Це стійкий, енергетично вигідний стан.
Приймаючи й віддаючи електрони, атом перетворюється на йон того самого елемента (атом Натрію — на йон Натрію), одержання нового елемента не відбувається — число протонів у ядрі не змінюється! А це, як ви пам’ятаєте, головна характеристика атома.
Йони — це заряджені частинки, що утворилися з атомів, або груші атомів внаслідок приєднання ними "чужих" або віддачі "своїх” електронів. Позитивно заряджені йони називають катіонами, негативно заряджені — аніонами.
Трохи відпочинемо від теорії й виконаємо завдання.
Завдання 1.
Напишіть електронні формули йонів: a) S2 , б) Al3'. Зовнішній рівень яких атомів повторює будову цих йонів?
Підказка: спочатку напишіть електронну або електронно-графічну формулу атомів. (Відповідь 1 дивіться наприкінці параграфа.)
Завдання 2
Завдання З
Атом елемента має на 2 електрони менше, ніж йон As3 . Визначте цей елемент, складіть електронну фор мулу його атома та йона. (Відповідь 3 дивіться наприкінці параграфа.)
Йон має таку будову: ««
Is 2s 2р . Припустіть, йони яких атомів могли б мати таку будову. (Відповідь 2 дивіться наприкінці параграфа.)
Підказка: якщо це йон, виходить, він уже прийняв або віддав певну кількість електронів.
ЙОННИЙ ЗВ'ЯЗОК
Йонний хімічний зв’язок існує між йонами — катіонами й аніонами, він досить міцний і здійснюється за рахунок електростатичних сил притягання.
Йонний зв’язок утворюється між активними металічними еле ментами й активними неметалічними елементами.
Завдання
Використовуючи таблицю електро-негативності, спробуйте скласти формули декількох речовин з йонним зв’язком.
Саме в них, як правило, досить великі різниці електронегативностей — більше 1,8-2.
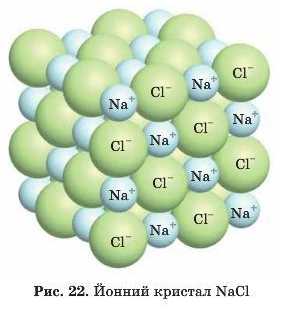
Розглянемо утворення цього зв’язку на прикладі кухонної солі — NaCl.
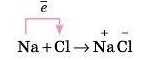
Праворуч у рівнянні реакції стоять заряди над Натрієм і Хлором, які показують число відданих і прийнятих електронів атомами елементів (тобто заряд йона).
ЙОННІСПОЛУКИ
Чи буде в сполуці NaCl один йон Na+ пов’язаний з одним йо-ном СГ, як у молекулі НС1? Давайте подумаємо. В атомів H і Cl но одному валентному електрону, тому' зв’язок між ними в молекулі може бути тільки один. Сполука NaCl складається з йонів, там немає спільних електронних нар, які могли б обмежувати кількість зв’язків (валентність). Так як же бути? Уявімо йони у вигляді кульок.
Електричне поле рівномірно спрямоване в усі боки, отже, навколо катіонів розміщується якась кількість аніонів, і навпаки. Скільки? Ця кількість залежить від різних чинників, наприклад розміру йонів. Тому говорити про молекулу з чітко визначеним складом відповідно до валентності елементів не має сенсу. Йони з різними зарядами утворюють йошшй кристал, де вони чергуються в певному порядку.
— Уявіть коробку із щільно укладеними кульками: білими та чорними.
Ось так приблизно і виглядає йонний кристал.
— Скільки білих кульок межує з чорними? Це можна порахувати. < Але число сусідів зовсім не співпадає з кількістю неспарених електронів.
У йонів узагалі їх немає.
Зокрема, у кристалі NaCI кожний йон Na' оточений б йонами Cl , і навпаки. Можна визначити відношення катіонів і аніонів: 6Na' : 6С1 або 1:1. Таким чином, у нашому прикладі на один йон Na' припадає один йон СГ. Тому склад йонної сполуки можна записати NaCL Такий запис називають формульною одиницею. Це не склад молекули, а співвідношення йонів у речовині.
Якщо атоми з’єднуються з допомогою ковалентного зв’язку — утворюються молекули, і формули цих речовин показують, які атоми й у якій кількості входять до складу молекули. Наприклад, CO2, H2SO4.
Якщо зв’язки в речовині йонні, то речовина складається з йонів і має будову йонного кристала. У цьому випадку використовують НЕ формули, а формульні одиниці, які показують співвідношення йонів. Наприклад, NaCl, KBr.
Хоча NaCl і CO2 записують за однаковими правилами, і виглядають вони схоже, у першому випадку — це формульна одиниця, а в другому — хімічна формула.
Як ви вже знаєте, використовуючи Періодичну' систему Д. І. Менделєєва, можна розрахувати відносну молекулярну масу. А як бути з формульними одиницями? Так само, як відносну молекулярну масу, можна розрахувати й відносну формульну масу.
ВЗАЄМОЗВ'ЯЗОК МІЖ ПОЛОЖЕННЯМ ЕЛЕМЕНТІВ
У ПЕРІОДИЧНІЙ СИСТЕМІ Й ТИПОМ ЗВ'ЯЗКУ
Як приклад можна простежити зміну' характеру зв’язків у сполуках другого періоду:

Під час руху зліва направо відбувається поступовий перехід від речовин з йонним зв’язком до речовин з ковалентним неполярним зв’язком відповідно до збільшення неметалічних властивостей елементів у періодах.
= ДІЗНАЙТЕСЯ БІЛЬШЕ
Потрібно сказати, що аніони й катіони можуть обмінюватися електронами, що споріднює йонний зв’язок з ковалентним. Тому між ковалентними та йонними зв’язками немає чіткої межі. Іноді йонний зв’язок розглядають як крайній випадок ковалентного полярного зв’язку. Чим більше різниця електронегативності, тим більше ступінь йонності.
Виходить, що зв’язок не буває йонним на 100%. Навіть у такій сполуці, як CsF, у якій найбільша різниця електронегативності (4,1-0,86 = 3,24), хімічний зв’язок є йонним тільки на 89%.
|
Різниця |
Ступінь йонності |
|
EH |
зв’язку, % |
|
0 |
0 |
|
0,5 |
6 |
|
1,0 |
22 |
|
1,5 |
44 |
|
Різниця EH |
Ступінь йонності зв’язку, % |
|
2,0 |
63 |
|
2,5 |
79 |
|
3,0 |
89 |
Таким чином, тип хімічного зв’язку залежить від того, атоми яких елементів його утворюють.
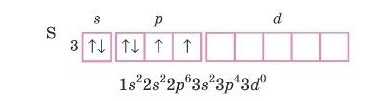
1. Запишемо електронну або електронно-графічну формулу зо внішнього рівня атома Сульфуру.
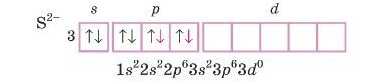
Тепер думаємо: запис S2 означає, що атом прийняв 2 електрони. Допишемо їх у електронну формулу.
ІЦоби зобразити йон AI'4 з електронної формули атома Алюмінію, заберемо 3 електрони.
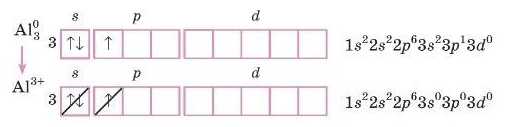
Будова зовнішнього енергетичного рівня S2 така сама, як у ато-
Oi
ма Аргону, а в Al' — як у атома Неону.
2. Наприклад, під час одержання зовнішнього рівня ls22s22pe атом прийняв 1 електрон, значить, у атома була будова \s22s22p' — це Флуор, а йон з будовою \s22s22p'' — йон F . Також можна продовжити наші міркування: якщо атом уже прийняв 2 електрони, то в нього була будова ls22s22p' і це був атом Оксигену. Ще можна міркувати так: якщо для одержання йона (1я22я22р0) атом віддав 1 електрон, то він був атомом Натрію (Is2 2 s2 2р yIis1) і т. д.
3. ('початку записуємо число електронів у атомі Арсену 33,
у йоні As'4 на З електрони більше: 33 + 3 = 36. За умовою, в атомі шуканого елемента на 2 електрони менше: 36 2 = 34.
Скільки в атомі електронів, стільки й протонів, отже, це елемент із порядковим номером 34 Селен.
ПЕРЕВІРТЕ СВОЇ ЗНАННЯ
1. Який зв’язок називають йонним? Між якими елементами вій утворюється?
2. Що таке йон? катіон? аніон?
3. З а таблицею значень електронегативності знайдіть елементи з найвищою електронегативністю; з найнижчою електроне-гативністю. Назвіть формули сполук із йонним зв’язком, які вони можуть утворювати.
ВИКОНАЙТЕ ЗАВДАННЯ
1. Атом елемента має на 2 електрони більше, ніж йон Літію Li+. Визначте цей елемент, складіть електронну формулу його атома та йона.
2. Йон елемента E2i має таку саму електронну будову, як і атом Аргону. Визначте цей елемент, складіть електронну формулу його атома та йона.
Підказка: напишіть будову атома Аргону й додайте 2 електрони.
3. Йон елемента E34 має таку саму будову, як і атом Ванадію. Визначте цей елемент, складіть електронну формулу його атома та йона.
Підказка: міркування, як і в попередньому завданні.
4. Наведіть приклади речовин з йонним зв’язком (не менше 5 речовин). Назвіть катіони й аніони.
5. Дано елементи:
СІ, Η, К, Fe, N, О, Ca, F, Ca.
Складіть із них формули речовин із ковалентним полярним, ковалентним неполярним і йонним зв’язком і заповніть таблицю:
|
Речовини з ковалентним полярним зв'язком |
Речовини з ковалентним неполярним зв'язком |
Речовини з йонним зв’язком |
6. Випишіть окремо сполуки з ковалентним неполярним, ковалентним полярним та йонним зв’язком:
1. Речовини можуть складатися з атомів, молекул, йолів. Виберіть формули атомів, молекул, йоиів із наведеного переліку: О, O2, O3, O2-, К, S, S8, S2-, SO2, SO3, SO2-, F, F2, F', POj , P4, P2O5. Укажіть формули простих і складних речовин, катіонів і аніонів.
2. Напишіть схеми утворення йонів з атомів Оксигену, Кальцію, Флуору, Алюмінію. Порівняйте будову атомів і йонів. Що в них спільного й чим вони відрізняються? Чи буде у них змінюватися радіус і як саме? Поясніть свою точку зору.
3. Запропонуйте формули двох катіонів і двох аніонів, що мають електронну конфігурацію, як у йона Флуору.
4. Із наведеного переліку виберіть речовини з ковалентним полярним, ковалентним неполярним та йонним зв’язком: S8, SO2, SO3, P4, P2O3, F, F2, KF, H2O, KOH, NaI, I2, II2S, N2, NO2, CsF, MgCl2.
5. Напишіть електронну схему утворення калій броміду, натрій сульфіду, магній оксиду.
6. Поняття «відносна молекулярна маса» застосовують до речовин молекулярної будови. До яких речовин можна застосувати це поняття, а до яких треба вводити поняття «відносна фор-мульна маса»: S8, SO2, H2SO3, P4, H3PO4, Cl2, MgF2, H2O, KOll, NaNO3, NO2, N2, NaOH, KH? Поясніть свою точку зору. Усно підрахуйте відносні молекулярні й відносні формульні маси цих сполук.
7. У невідомого елемента А на б електронів більше, ніж у йона Флуору. Визначте невідомий елемент А і запропонуйте сполуки, утворені цим елементом з ковалентним полярним, ковалентним неполярним і йонним зв’язком. Які з цих речовин будуть добре розчинятися у воді?
8. Ще давні знали, що подібне розчиняється у подібному. Це правило можна перекласти на сучасний лад: «У полярному розчиннику будуть добре розчинятися полярні та йонні сполуки». Які з речовин із завдання 4 будуть добре розчинятися у воді?
9. Газ метай, який іще називають болотним газом через утворення його у великих кількостях на болотах, погано розчиняється у воді. Чи не суперечить цей факт правилу давніх, що подібне розчиняється в подібному? Поясніть свою точку зору.
10. У якому розчиннику воді чи бензині будуть добре розчинятися кристали кухонної солі, йоду? Поясніть свою точку зору.
Це матеріал з підручника Хімія 8 клас Гранкіна
Автор: admin от 21-09-2016, 00:01, Переглядів: 8213