§ 9. Ковалентний полярний і неполярний зв'язок
— Що сталося б, якби не було хімічного зв’язку?
— Атоми були б розрізненими частинками, і не було б ніяких речовин, ні простих, ні складних, і навіть нас.
НАВІЩО ПОТРІБНИЙ ХІМІЧНИЙ ЗВ'ЯЗОК?
Відповідно до спостережень вчених, атоми намагаються заповнити всі порожні орбіталі на зовнішньому рівні. При цьому атом може використовувати також електрони інших атомів. Досягти цього можна, утворюючи сполуки за допомогою хімічних зв’язків. Виділяють ковалентні, йонні, металічні та інші зв’язки.
Тепер про кожний зв’язок докладніше.
КОВАЛЕНТНИЙ ЗВ'ЯЗОК
Запам’ятаємо: ковалентний зв’язок утворюється зазвичай між атомами неметалічних елементів.
Процес утворення ковалентного зв’язку може відбуватися по-різному. Розрізняють два основних механізми утворення цього зв’язку: обмінний і донорно-акцепторшій.
Обмінний механізм ми розглянемо зараз, а донорно-акцептор-ний ви будете вивчати у старших класах.
Існують два види ковалентного зв’язку: полярний і неполярний. Для того щоби розібратися зі зв’язками, передусім варто згадати, що таке електронегативність.

Електронегативність (EH) — це здатність атома в молекулі притягувати до себе валентні електрони, які беруть участь в утворенні хімічного зв’язку.
Ковалентний неполярний зв'язок
Розглянемо обмінний механізм утворення ковалентного неполярного зв’язку.
Ковалентний неполярний зв’язок утворюється між атомами неметалічних елементів із приблизно однаковою елек-тронегативністю.
Приклад
Елементами з приблизно однаковою електронегативністю прийнято вважати такі, у яких різниця значень електронега-тивності незначна: від 0 (однакові ЕН) до 0,4.
Які ж речовини утворені елементами з однаковою електронегативністю? Придумали? Якщо ні, от підказка: H2, O2, O3, Cl2, а є ще S8, Pi. Це зрозуміло, адже до складу цих молекул входять однакові атоми, отже, і електронегативність у них однакова. Тепер візьмемо таблицю електронегативностей (див. табл. З на с. 56). Знайдіть елементи, в яких різниця електронегативностей незначна . Не забувайте, що ми шукаємо тільки неметали. От, наприклад:
• C (ЕН дорівнює 2,5) і S (ЕН дорівнює 2,6);
• H (ЕН дорівнює 2,1) і P (ЕН дорівнює 2,1) — очевидно, у цих випадках зв’язок ковалентний неполярний.
Механізм утворення ковалентного неполярного зв'язку
Розглянемо, як і чому утворюється ковалентний неполярний зв’язок. Кожен атом, що боре участь в утворенні хімічного зв’язку, прагне завершити свій зовнішній рівень, тобто на зовнішньому рівні в нього має бути 8 електронів (октет). Винятком є Гідроген, у якого завершений перший рівень має 2 електрони.
Наприклад, розглянемо утворення молекули водню. У кожного атома Гідрогену є неспарений електрон.

У випадку, якщо два атоми об’єднаються в молекулу, атоми матимуть можливість використовувати електрони один одного для завершення рівня.
Для початку атоми мають зіштовхнутися.
При цьому відбувається таке: електронна орбіталь одного атома притягується ядром іншого атома:
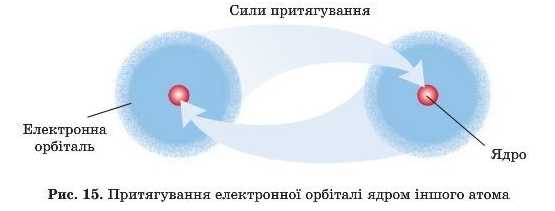
Атоми зближуються. Це зближення відбувається доти, поки не почнуть відштовхуватися ядра атомів і електронні оболонки.
Хімічний зв’язок утворюється, коли сили притягання й відштовхування між ядрами й електронними оболонками дорівнюватимуть одна одній.

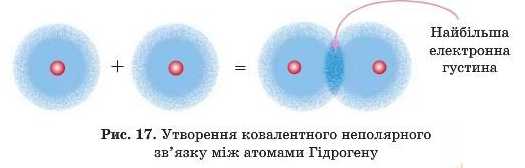
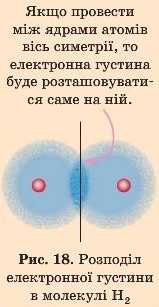
Неспарені електрони обох атомів утворюють загальну електронну пару, яка належить обом атомам. При цьому виникає спільна електронна орбіталь із найбільшою електронною густиною в між’ядерному просторі, що врівноважує відштовхування позитивно заряджених ядер.
Таким чином, утворення ковалентного неполярного зв’язку між атомами Гідрогену можна зобразити так:
— Я зроз^^мів: електронні орбі-талі обох атомів ніби змішались в одну велику хмару.
Схематично показують ковалентний зв’язок двома крапками між атомами: Н:Н. Це електронна формула. Крапки тут позначають електрони, які беруть участь в утворенні зв’язку.
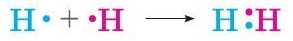
Але це зовсім не означає, що там замість крапок постійно перебувають два кругленьких електрончики. Просто між ядрами майже весь час є ділянка, в якій імовірність перебування цих електронів дуже висока.
Замість двох крайок можна намалювати одну риску — один зв’язок: Н-Н. Це структурна формула.
Зверніть увагу: умовою утворення ковалентного зв’язку є протилежна спрямованість спинів електронів!

Ділянка найбільшої електронної густини, утворена за перекривання електронних хмар, у цьому випадку не зміщена до жодного з атомів у молекулі тому, що в них однакова електронегативність.
Завдання
Спробуйте 5» самостійно розглянути утворення молекул фтору, хлору. Намалюйте електронну будову їх зовнішніх рівнів, укажіть спільні електронні пари, визначте, які електрони їх утворюють, а також запишіть електронні й структурні формули.
Відповідно, ядра атомів з однаковою силою притягують до себе спільні електрони.
Це і є особливістю ковалентного неполярного зв’язку.
Механізм утворення зв’язку — обмінний, тому що атоми ніби обмінюються електронами.
Приклад
Розглянемо утворення молекули азоту. Три неспарені електрони на зовнішньому рівні атома Нітрогену утворюють загальні пари:
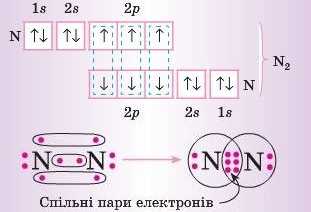
Якщо замінити кожну спільну пару електронів однією рискою, одержимо структурну формулу: N=N
Зверніть увагу, що поняття валентність, яке ви вивчали в 7 класі, тут дістає підтвердження на електронному рівні. Кожний неспарений електрон утворює один зв’язок. Тому' кількість неспарених електронів визначає кількість зв’язків — валентність: Гідроген, Хлор і Флуор, як ми бачимо, одновалентні, а Нітроген — трьохвалентний.
Число неспарених електронів відповідає числу спільних електронних пар, дорівнює числу ковалентних зв’язків, дорівнює валентності атома в сполуці.
Ковалентний полярний зв'язок
Ковалентний полярний зв’язок утворюється між немета-лічними елементами з різною електронегативністю.
Приклад
Різниця електронегативностей атомів, які беруть участь ^
в утворенні ковалентного полярного зв’язку, у цьому випадку приблизно дорівнює від 0,4 до 1,7. Пошукаємо в таблиці елек-тронегативності (див. табл. З на с. 56) такі неметалічні елементи: H (2,1) і Cl (2,83), різниця 2,83 - 2,1 = 0,7.
C (2,5) і F (4,1), різниця 4,1 - 2,5 = 1,6.
H (2,1) і O (3,5), різниця 3,5 - 2,1 = 1,4.
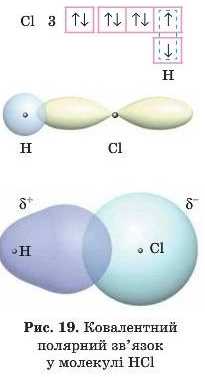
Механізм утворення ковалентного полярного зв’язку подібний до механізму' утворення ковалентного неполярного зв’язку, тільки загальна електронна густина буде зміщена до більш електронегативного елемента.
Розглянемо утворення молекули НС1. 5
Завдання
Завдання
Припустіть, яка з молекул буде більш полярною:
HF, НС1, HBr, НІ?
Підказка: порівняйте електронегативність цих елементів. (Відповідь 1 у кінці параграфа.)
Схематично зобразіть утворення ковалентних зв’язків у молекулі H2O. Напишіть електронну й структурну формули.
Підказка: спочатку визначте, скільки неспарених електронів у атома Оксигену. (Відповідь 2 у кінці параграфа.)
Ковалентний зв'язок і змінна валентність
Валентність кожного елемента обмежена числом неспарених електронів, здатних брати участь в утворенні зв’язків (валентних електронів), тому кожний атом утворює тільки чітко визначене число ковалентних зв’язків у молекулі.
Згадайте, що в разі одержання додаткової енергії електрони зовнішнього рівня атома можуть розпарюватися, переходити на порожні орбіта лі (якщо, звичайно, вони на цьому' рівні є). Число неспарених електронів збільшується, а отже, збільшується валентність. Перехід електронів на інші орбіталі (промотування) пояснює змінну валентність. Про це ми говорили під час вивчення розподілу електронів у атомах.
Розглянемо утворення молекули вуглекислого газу CO2. Атом Карбону в цьому випадку перебуває у нромотованому стані, він чотиривалентний.
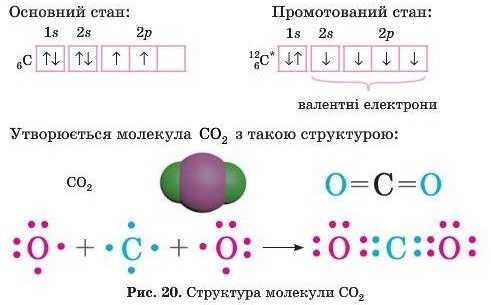
Насправді провести чітку межу між ковалентними полярними й неполярними зв’язками майже неможливо. Часто говорять про більш-менш виражену полярність зв’язку.
Отже, потрібно запам’ятати:
• Ковалентні зв’язки утворюються між неметалічними елементами.
• Якщо електронегативність цих елементів однакова, зв’язки ковалентні неполярні, різні електронегативності — ковалентні полярні.

ВІДПОВІДІ ДО ЗАВДАНЬ ПАРАГРАФА
Відповідь 1. Чим більша різниця електронегативностей, тим більш полярним є зв’язок:
|
Сполуки |
Різниця EH |
Полярність |
|
HF |
2,0 |
найбільш полярна |
|
HCl |
0,7 |
|
|
HBr |
0,6 |
полярність зменшується |
|
НІ |
0,1 |
найменш полярна |
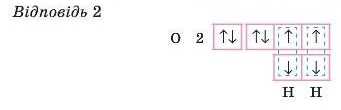
ДІЗНАЙТЕСЯ БІЛЬШЕ
Трохи розповімо про складання структурних формул. їх записують для речовин з ковалентними полярними зв'язками, але іноді використовують і для йонних сполук, якщо це допомагає пояснити новий матеріал. Ці формули показують, у якому порядку з'єднані атоми, і дають загальне уявлення про будову молекули. Розглянемо основні принципи складання таких формул:
• треба, щоб число атомів у молекулярній і структурній формулах було однакове;
• обов'язково стежити, щоб валентність елементів дорівнювала кількості зв’язків (рисок) у структурній формулі.
Наведемо кілька прикладів.
Оксиди
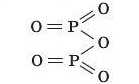
Наприклад, складемо структурну формулу P2O5. Фосфор тут п’ятивалентний, Оксиген, як завжди, — двовалентний. Записуємо спочатку атоми оксидотвірного елемента — Фосфору:
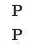
Навпроти записуємо атоми Оксигену:
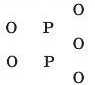
В утворенні зв’язків беруть участь р-електрони атома Оксигену.
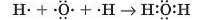
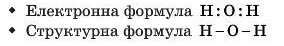
З'єднуємо їх зв’язками — рисками, при цьому стежимо, щоб від кожного атома Фосфору відходило 5 рисок, а від кожного атома Оксигену — по 2. Виходить так:
Кислоти
Під час складання формул оксигеновмісиих кислот пам'ятаємо, що це гідроксиди. Запишемо структурну формулу H2SO4. Спочатку
визначимо валентність: H — одновалентний, O — двовалентний, S — шестивалентний. Спочатку запишемо гідроксигрупи. їх стільки, скільки атомів Гідрогену.

Потім — кислототвірний елемент і решту Оксигену:
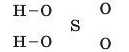
З’єднаємо записані атоми рисками — зв’язками, пам’ятаючи про валентності!
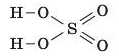
Формула готова.
ПЕРЕВІРТЕ СВОЇ ЗНАННЯ
1. Які електрони називають валентними?
2. Між якими елементами в молекулі утворюється ковалентний полярний зв’язок? ковалентний неполярний?
3. Наведіть приклади речовин:
а) з ковалентним полярним зв’язком;
б) з ковалентним неполярним зв’язком.
ВИКОНАЙТЕ ЗАВДАННЯ
1. Розподіліть наведені речовини в таблиці:
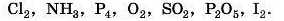
|
Речовини з ковалентним неполярним зв’язком |
|
|
Речовини з ковалентним полярним зв’язком |
2. Позначивши неспарені електрони атома Нітрогену й електрон Гідрогену крапками, намалюйте схему утворення ковалентних зв’язків у молекулі амоніаку NHa. Укажіть вид ковалентного зв’язку, поясніть вашу схему.
3. Зобразіть схему утворення молекул:
а) з ковалентним полярним зв’язком;
б) з ковалентним неполярним зв’язком.
Молекули для цих прикладів підберіть самостійно.
4. Наведіть приклади речовин, до складу яких входить Оксиген, з ковалентним полярним і неполярним зв’язком. Напишіть електронні й структурні формули цих речовин.
5. В основному чи нромотованому стані перебувають атоми Фосфору й Сульфуру під час утворення молекул PCl3 і PCl5, H2S і SO3?
ДОДАТКОВІ ЗАВДАННЯ
1. Відомо, що в утворенні хімічного зв’язку беруть участь валентні електрони. На якому енергетичному рівні перебувають валентні електрони в атомах Оксигену, Сульфуру, Фосфору, Йоду, Селену?
2. Чому Оксиген і Флуор не проявляють найвищу валентність, як їхні сусіди по родині? Поясніть це з точки зору будови атомів.
3. Поясніть, які валентності можуть проявляти Сульфур, Силіцій, Хлор, написавши будову атомів у основному та промото-ваному станах.
4. Ковалентний зв’язок утворюється за рахунок спільних електронних пар між атомами неметалічних елементів. Від чого залежить кількість спільних електронних нар? Скільки спільних електронних пар утворюється між атомами в молекулах кисню, фтору, азоту? Напишіть електронну й структурну формули цих сполук.
5. Напишіть електронні схеми утворення молекул брому, гідроген броміду (леткої водневої CHOJtyKH Брому), гідроген сульфіду (леткої водневої сполуки Сульфуру), амоніаку (леткої водневої сполуки Нітрогену), йоду. Укажіть типи хімічного зв’язку в молекулах цих сполук. Чим відрізняється ковалентний полярний зв’язок від ковалентного неполярного?
6. Дайте визначення поняття електроиегативність. Поясніть, як змінюється електронегативність у періодах і групах? Для елементів другого, третього періоду, для галогенів і лужних елементів укажіть елементи з найменшим і найбільшим значенням електронегативності.
7. Карбон є найголовнішим елементом органічних сполук, де він проявляє тільки одну свою валентність, хоча в неорганічній хімії трапляються його сполуки й з іншою валентністю. Які
валентності може проявляти Карбон, якщо написати будову його атома в основному й иромотованому станах. Зробіть висновок щодо валентності Карбону' в органічних сполуках, якщо відомо, що до складу цих сполук він входить у промотованому стані. Напишіть електронну схему утворення молекули метану (леткої водневої сполуки Карбону) і запропонуйте структурну формулу цієї молекули. У якому напрямі будуть зміщуватися спільні електронні пари?
Це матеріал з підручника Хімія 8 клас Гранкіна
Автор: admin от 21-09-2016, 00:00, Переглядів: 29813