§ 7. Періодична система хімічних елементів з позиції теорії будови атома
За багато років роботи над Періодичною системою Д. І. Менделєєв створив. як він сам писав, природну систему елементів. Природна це така система, в якій кожний елемент стоїть на своєму місці, що відповідає його властивостям.
Правильність розташування елементів у таблиці підтвердилася під час вивчення будови атома. Якби Д. І. Менделєєв був живий у той час, коли вчені створювали теорію будови атома, і бачив, як чудово збігається положення елемента в Періодичній системі з будовою ядер і електронних оболонок атомів цього елемента, напевно, він був би цілком щасливий.
ЕЛЕКТРОННІ РОДИНИ Й СТРУКТУРА ПЕРІОДИЧНОЇ СИСТЕМИ
Згадаємо (або повторимо § 2), що в Періодичній системі Д. І. Менделєєва виділяють групи й періоди. У короткому варіанті Періодичної системи кожна група ділиться на головну (А) і побічну (Б) підгрупи.
Завдання
Знайдіть і назвіть ’ s-елементи T (А)
1 II (Λ) підгруп
2 і 3-го періодів.
Можлива відповідь: Літій, Берилій, Натрій, Магній.
Зіставимо розташування елементів у підгрупах та їхні електронні родини.
В елементів, які перебувають у головних підгрупах І і II груп, на зовнішньому рівні 1 або 2 електрони.
Завдання
Знайдіть і назвіть будь-які три релементи 3-го періоду.
Можлива відповідь: Силіцій, Сульфур, Аргон.
Вони розташовуватимуться на орбі-талі .s-підрівня. Виходить, у головних (Λ) підгрупах І і Il груп розташовані .s-елементи. До .s-елементів належать також елементи 1-го періоду — Гідроген і Гелій.
В елементів, які розташовані в головних підгрупах TTI-VTIT груп, заповнюються о рб і талі р-підрівня. Цс р-елементи.
Всі елементи, які становлять побічні підгрупи, належать до (/-елементів.
(/-елементи називають іще перехідними елементами, тому що вони ніби стоять на переході від з- до р-елементів.
C ще хімічні елементи, в яких заповнюються орбіталі /-нідрівня. їхні символи розташовані у два ряди внизу Періодичної системи (див. форзац)·
T навіщо це все вивчати? Я помітив, у таблиці клітинки із s-елементами розфарбовані в червоний колір, з р-елементами у жовтий, з rf-елементами — у синій.
А внизу — зелені /-елементи! Я все знаю!
— А якщо таблиця не кольорова?
A-а... у-у... Тоді треба вчити. 3
потім ідуть d-елементи (тільки з 4-го періоду), і наприкінці шість груп — р-елемепти. Ви можете користуватися тим варіантом таблиці, який зручніший для вас.
ДЕЯКІ ВАЖЛИВІ ПОНЯТТЯ, ЯКІ ПОВ'ЯЗУЮТЬ БУДОВУ АТОМА
Й ПОЛОЖЕННЯ ЕЛЕМЕНТІВ У ПЕРІОДИЧНІЙ СИСТЕМІ
Щоби зіставити розташування елемента в Періодичній системі та його властивості з будовою атомів цього елемента, нам потрібно знати деякі важливі поняття. Якісь із них ми вже знаємо, з іншими будемо знайомитися.
Валентні електрони
Валентними називають електрони, які можуть брати участь в утворенні хімічних зв’язків.
Для елемептів 1-3-го періодів — це електрони зовнішніх (останніх) рівнів.
Валентність
Це поняття вам знайоме із 7 класу. Повторимо: валентність — це здатність атома утворювати хімічні зв’язки.
Тепер ми можемо визначити чисельне значення валентності, спираючись на будову електронної оболонки атома.
Чисельно валентність, як правило, дорівнює кількості не-спарених електронів.
Це електрони зовнішнього (останнього) рівня. Але електрони па цьому рівні можуть бути спареними й неспареиими. Як це зіставити з тим, що валентність дорівнює номеру групи (як ви вивчали в 7 класі)? До того ж існує постійна та змінна валентність.
Завдання
•Зобразіть електронно-графічну будову зовнішнього рівня атома Оксигену.
Скільки в нього неспарених електронів? Яка валентність Оксигену?
Відповідь 1 дивіться наприкінці параграфа.
Завдання
Зобразіть електронно-гра- 'фічну будову зовнішнього рівня атома Літію.
Скільки в нього неспарених електронів? Яка валентність Літію?
Відповідь 2 дивіться наприкінці параграфа.
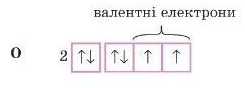
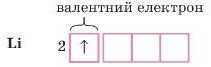
Отже, ми бачимо, що в атомі Оксигену два носпарених електрони, значить, вій двовалентний. Б атомі Літію один иеспаре-ний електрон. Він одновалентний. І Оксиген, і Літій проявляють постійну валентність, іншого значення валентності в них немає. Але є елементи, в яких кілька значень валентності.
Розглянемо, що відбувається в атомі в елементів зі змінною валентністю. Зобразимо електронно-графічну будову зовнішнього рівня атома Фосфору.
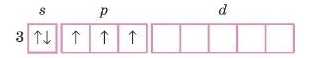
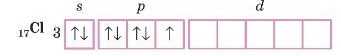
На зовнішньому рівні три неепарених електрони. Де основний стан атома. Валентність Фосфору в основному стані дорівнює трьом.
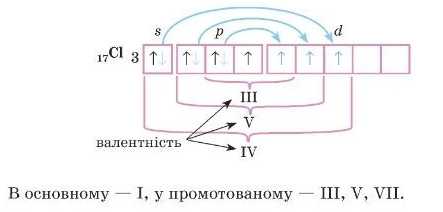
Однак під час одержання додаткової енергії, наприклад у разі зіткнення атомів або поглинання світла, можливий перехід електрона з одного підрівня на інший у межах одного рівня:
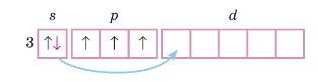
Такий процес називають промотуванням. 4
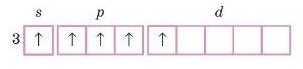
Валентність, що дорівнює номеру групи, називають вищою валентністю.
Зверніть увагу, валентність елементів IA-IIIA підгруп постійна й дорівнює номеру групи. Для елементів зі змінною валентністю тільки одна з валентностей е вищою. В елементів Нітрогену, Окош ену, Флуору вшца валентність не дорівнює номеру групи.
Це пояснюють тим, що в цих елементів немає d-підрівня, куди могли б перескочити електрони під час розпаровування (промотування).
— Так іцо, треба щоразу для визначення валентності записувати будову зовнішнього рівня атома?
— TTe обов’язково. Можна порахувати гак: перша — вища валентність, дорівнює номеру групи, потім віднімаємо цифру 2 — одержуємо наступну валентність, потім, якщо можна, ще віднімаємо 2 і т. д. Наприклад, для елементів IV групи можливі валентності TV і (4 2) IT. Для елементів VII групи VII, (7-2) V, (5-2) III, (3-2) І.
Чому віднімати треба 2?
Тому що під час промотування з однієї електронної пари утворюється два неспярених електрони, і валентність збільшується на 2. ІТнаючи вищу валентність, ми можемо розрахувати більш низькі валентності — просто потрібно віднімати 2.
ЕЛЕКТРОНЕГАТИВНІСТЬ
Електронегативність (EH) це властивість ядра атома притягувати до себе валентні електрони. Чим більше значення електронегативності, тим сильніше ядро притягує й утримує як власні валентні електрони, так і валентні електрони, отримані від інших, сусідніх атомів.
ДІЗНАЙТЕСЯ БІЛЬШЕ
Хіміки оцінюють електронегативність атома, порівнюючи величини енергії, яка виділяється під час приєднання електрона до атома, і енергії, яку потрібно витратити, щоби відірвати електрон від атома. Однак найчастіше використовують більш просту величину, запропоновану Нобелівським лауреатом Лайнусом Полінгом, відносну атомну електронегативність.
Чисельні значення електронегативності можна знайти в таблиці «Відносні електронегативності» (табл. 3).

Приклад
Розгляньте таблицю електронегативності. Знайдіть елемент із найвищою електронегативністю. Це... Флуор. Він буде відтягувати на себе валентні електрони навіть від атома Оксигему, який, у свою чергу, посідає друге місце за величиною електронегативності. А тепер знайдіть елементи з найнижчою електронегативністю. Знайшли? Це елементи ТА групи.
Зверніть увагу, що атоми з високою електронегативністю, наприклад Флуор, Оксигсн, утворюють молекули активних неметалів фтору та кисню, а з атомів елементів із низкою електронегативністю, наприклад, ТА і НА підгруп утворюються метали лужні й лужноземельні. У формулах зазвичай на першому місці пишуть символ елемента з нижчою електронегативністю.
Заберіть цей 7>.\
У мене низька електронегативність.
Все моє-є-є!
Я найбільш сл сктрон стати впий!
МЕТАЛІЧНІ Й НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ
Із розподілом усіх елементів на металічні й неметал Ічні ви знайомилися ще в 7 класі.
Металічними називають ті елементи, атоми яких утворюють прості речовини метали, а атоми неметалічних елементів утворюють прості речовини неметали.
До металічних елементів належать s-елементи (крім Гідрогену й Гелію), усі сі- і /-елементи, а також частина р-слсмснтів. До неметалічних s-елементи Гідроген і Гелій і частина р-елементів.
Як же визначити, де в Періодичній системі металічні й неметал Ічні елементи? Треба провести діагональ від Бору до Астату. Це зручно зробити в довгому варіанті Періодичної системи. Елементи, які перебувають на цій прямій і правіше, — не-металічні елементи, елементи, розташовані лівіше, металічні (табл. 4, 5).

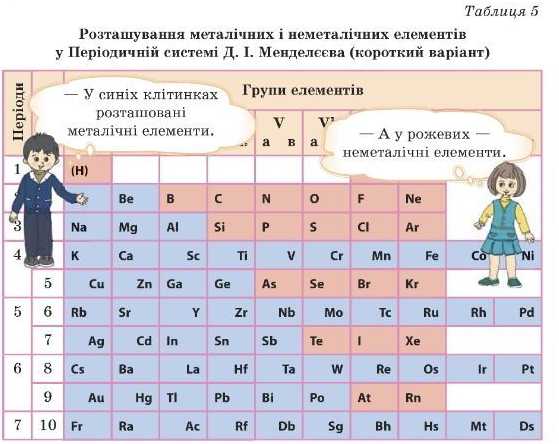
Порівнюючи електронегативності елементів, ми бачимо, що металічні елементи легше віддають електрони під час утворення сполук з атомами інших елементів, а неметалічні елементи активніше електрони забирають. Це досить умовно, але слід запам’ятати. Тому прийнято вважати, що зі збільшенням електронегативності неметалічні властивості елементів підсилюються, а металічні слабшають.
ВІДПОВІДІ ДО ЗАВДАНЬ ПАРАГРАФА
Відповідь 1. Електронно-графічна будова зовнішнього рівня атома Оксигену:
Відповідь 2. Електронно-графічна будова зовнішнього рівня атома Літію:
Відповідь 3. Валентність атома Cl в основному стані:
та промотованому станах:
ПЕРЕВІРТЕ СВОЇ ЗНАННЯ
1. В яких групах і підгрупах у Періодичній системі пере- ' б у ва ют ь .S - ел еме н ти ? p-ejіем е н ти ? d-е л е м е н т и ?
2. Укажіть, де в Періодичній системі розташовані елементи з постійною валентністю? зі змінною валентністю?
3. Чим обумовлена змінна валентність?
4. Чому в атомів Оксигену, Нітрогену, Флуору вища валентність не дорівнює номеру групи?
5. Які електрони називають валентними?
6. Чому чисельно дорівнює валентність?
7. Яке значення валентності називають вищою валентністю?
8. Що таке промотування й коли можливий цей процес?
9. ІДо таке електронегативність? Назвіть елементи з найбільшою та найменшою електронсгативністю.
10. Як можна визначити металічні й неметалічні елементи, застосовуючи поняття електронегативності?
ВИКОНАЙТЕ ЗАВДАННЯ
1. Виберіть окремо символи s-елементів і р-елементів:
Na, К, Cl, II, S, Be, Cs, Se, Sn, Не.
2. Виберіть окремо елементи з постійною та змінною валентністю:
Калій, Бор, Нітроген, Бром, Рубідій,
Стронцій, Селен, Германій.
3. Визначте всі можливі валентності атома Карбону. Підтвердьте свою відповідь електронно-графічними формулами.
4. Елемент у різних сполуках проявляє валентність, що дорівнює VII, V, III і І. Який це може бути елемент?
5. Визначте валентності в атомів:
✓ Селену,
✓ Силіцію,
✓ Йоду,
✓ Арсену
в основному та промотованому станах.
6. Атом елемента має таку будову зовнішнього рівня: ...3s Sp'. Назвіть елемент, визначте валентність у основному й промото-ваному етапах.
а) Al, III;
б) N, IV, II;
в) As, 111;
г) Р, 111, V.
7. На зовнішньому рівні атома сім валентних електронів. Яка електронна формула може бути в цього атома?
а) 3s2Зр5;
б) 3s23p‘;
н) 2s22p‘;
г) 3s23p°.
8. Чому дорівнює валентність Сульфуру в основному й промотованому станах?
а) II, III, IV;
б) I, II, III;
в) VT, TV, Ti;
г) III, V, VII.
9. Укажіть кількість валентних електронів у атомі Нітрогену:
а) 5;
б) 7;
в) 10;
г) 3.
Це матеріал з підручника Хімія 8 клас Гранкіна
Автор: admin от 20-09-2016, 23:59, Переглядів: 4957