§ 6. Будова електронних оболонок атомів хімічних елементів № 1-20. Електронні та графічні електронні формули
Учитель нам говорив про якісь електронні формули. Коли ж ми будемо їх писати?
— Зараз і будемо. Ти пам’ятаєш, про що йшлося в попередньому параграфі?
— Так. В атомі є електронні шари, або рівні...
— ...які діляться на підрівні — я, р, d...
— ...а підрівні — на орбіталі...
— ...на s-підрівні одна орбіталь, на р — три, на d — п’ять...
— ...а на кожній орбіталі один або два електрони!
Точно! Це все нам зараз знадобиться.
ПРАВИЛА РОЗПОДІЛУ ЕЛЕКТРОНІВ У АТОМІ
Зараз ми будемо навчатися писати електронні формули, які показують як улаштована електронна оболонка атомів. При цьому треба враховувати, що кожний електрон насамперед буде займати найбільш енергетично вигідне положення.
Принцип мінімуму енергії: в атомі кожний електрон розташований так, щоби його енергія була мінімальною.
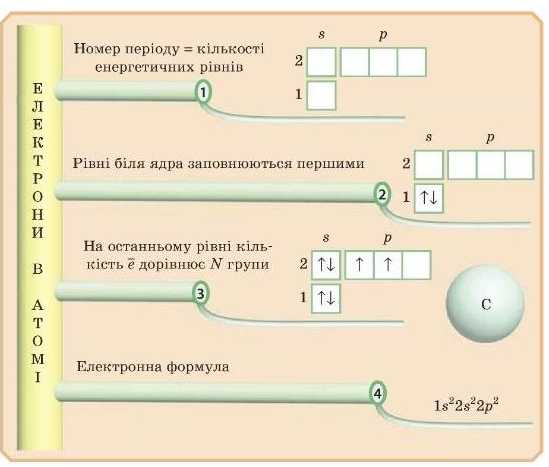
Отже, порядок заповнення енергетичних рівнів і підрівпів у атомі відповідає збільшенню їхньої енергії. Розгляньте рис. 11 і продумайте цей порядок.
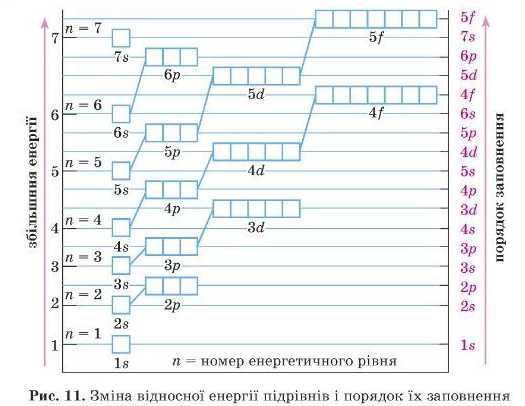
Повторимо й запам’ятаємо правила заповнення електронами рівнів і підрівпів:
Найбільш енергетично вигідні рівні розташовані найближче до ядра. Тому саме з них і буде починатися заповнення енергетичних рівнів електронами.
Найбільш енергетично вигідний s-підрівень, а отже, він буде заповнюватися першим на кожному рівні, потім заповнюватиметься р-підрівень.
Атом кожного наступного елемента за порядком у таблиці Д. І. Менделєєва повторює електронну будову попереднього атома плюс іще один електрон.
Для елементів головної підгрупи кількість електронів на зовнішньому рівні дорівнює номеру групи, в якій розташований елемент.
ЕЛЕКТРОННО-ГРАФІЧНІ Й ЕЛЕКТРОННІ ФОРМУЛИ ЕЛЕМЕНТІВ 1 І 2-го ПЕРІОДІВ
Гідроген
Визначимо, як розташований електрон у атомі Гідрогену.
1. За пи с у є м о с и м вол e./1 е м е н та і й о і ч> 11 о рядковий но м е р.
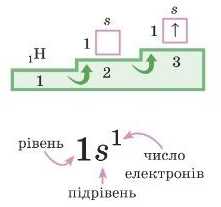
2. Гідроген розташований у першому періоді, отже, електронами буде заповнюватися перший енергетичний рівень. На цьому рівні один s-підрівеиь.
3. На а-підрівні один електрон.
Це електронно-графічна формула (графічна тому, що ми ие тільки писали, але й малювали).
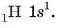
Можна також написати електронну формулу:
Гелій
Написати розподіл електронів у атомі Гелію теж досить просто. Звичайно, продовжить заповнюватися той самий енергетично вигідний перший рівень. Тут слід згадати, що на одній орбіталі може бути два електрони, і дописати ще один електрон у формулу Гідрогену, отриману в попередньому прикладі:
Електронна формула:
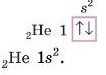
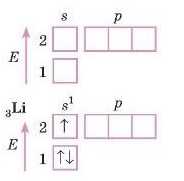
Літій
Розподіл електронів у атомі Літію пишемо таким чином: Літій елемент 2-го періоду, отже, малюємо перші два рівні.
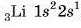
Перший рівень — найбільш вигідний, із найнижчою енергією заповнений повністю ще в Гелію, тому третій електрон Літію розташований на другому рівні s-підрівні. Літій у І групі, на зовнішньому рівні має один електрон. Електронна формула:
Якщо останній електрон перебуває на s-підрівні, то говорять, що елемент належить до s-елементів, якщо на р-нідрівні — до p-елементів. Так, Ii і lie, Li s-елементи.
Використовують іноді що таку назву: електронна родина. Наприклад, можна сказати так: «Берилій належить до електронної родини s-елементів». Електронна формула Берилію ,Be Is22s2.
Завдання
Спробуйте визначити, до якої електронної родини належатиме Бор.
Відповідь. 2з-підрівень заповнений, значить, електрон з’явиться на р-підрівні. Це р-елемент.
Розглянемо тепер електронну будову p-елементі в.
Нітроген
Запишемо електронно-графічну формулу атома Нітрогену.
1. Елемент у другому періоді — малюємо два рівні.
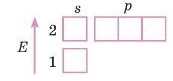
2. Перший рівень заповнений повністю.
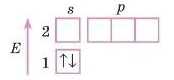
3. А от тепер дуже важливо: дивимося, в якій групі перебуває Нітроген — у п’ятій. Отже, в нього на зовнішньому рівні п’ять електронів. Тому пишемо на s-підрівні два електрони, а три, що залишилися, розташовуємо нар-підрівні. При цьому пам’ятаємо, що спочатку слід записувати по одному електрону на кожній орбіталі.
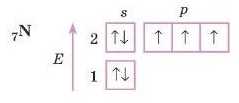
Електронна формула: 7N Is2 2s2 2р2.
У Нітрогену заповнюється р-підрівень це р-елемент.
Головне, не варто міркувати так: «Як би хитро розташувати всі сім електронів Нітрогену, щоб було правильно?»
Просто записуйте формулу, дотримуючись правила мінімальної енергії, і стежте, щоб на останньому, зовнішньому рівні число електронів дорівнювало номеру групи. Якщо ви захочете перевірити, чи всі електрони розподілені, порахуйте їх потім, після написання формули.
Тепер запишемо електронно-графічну й електронну формули для елемента 3-го періоду, наприклад Сульфуру. Спробуйте зробити це самі. Якщо ви ще не впевнені у своїх силах — працюємо разом. Уважно стежте за нашими міркуваннями.
Сульфур
1. Визначимо, в якому періоді розташований елемент, будову атома якого ми записуємо: цьому числу відповідає кількість енергетичних рівнів. Елемент Сульфур розташований у 3-му періоді, тому записуємо три енергетичних рівні:
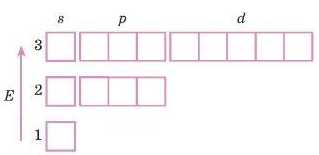
2. Перший і другий рівні найбільш енергетично вигідні, тому вони заповнюються першими: 2
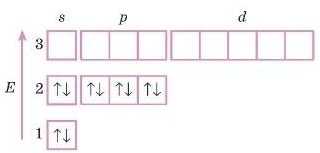
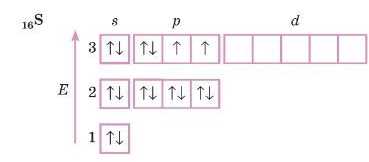
4. Перевіряємо правильність запису розподілу електронів по рівнях і підрівпях у атомі Сульфуру. Не забудьте, що загальна кількість електронів у атомі цього елемента дорівнює його порядковому номеру (для атома Сульфуру це число дорівнює 16). rf-підрівень у цьому атомі, як найбільш енергетично невигідний, залишається пезаповиеиим.
Розподіл електронів у атомі Сульфуру запишемо у вигляді електронної формули: 16S Is22s22р6ЗS23р4. Це д-елемент.
ЯК ЗАПИСАТИ БУДОВУ ТІЛЬКИ ЗОВНІШНЬОГО РІВНЯ АТОМА
Властивості атома значною мірою залежать від будови зовнішнього рівня. Тому ми, вивчаючи, наприклад, хімічні зв’язки, будемо розглядати тільки зовнішній, останній енергетичний рівень атома. Попередні рівні можна не записувати. Як же тоді правильно записати зовнішній рівень?
Приклад
Розглянемо це на прикладі атома Фосфору.
1. Визначаємо, u якому періоді розташований Фосфор. У третьому. Пишемо будову третього рівня:

2. Дивимося, в якій групі розташований цей елемент. У п’ятій. Розподіляємо п’ять електронів на третьому рівні: два електрони — на я-підрівень, три, що залипшлися, — на р-підрівень:

Приклад
Тепер розв’яжемо іншу задачу: визначимо за будовою зовнішнього рівня, атому якого елемента він належить. Наприклад, будова зовнішнього рівня така: ../Ss2Spli. Міркуємо так:
1) Заповнюється третій рівень, значить, елемент розташований у 3-му періоді.
2) На зовнішньому рівні в нього 2 + 2 = 4 електрони, отже, елемент розташований у IV групі. Це р-елемент.
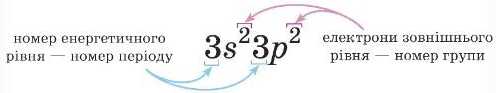
3) Шукаємо в Періодичній системі клітинку на перетині 3-го періоду й IV групи. Цей елемент Силіцій.
Отже, ми дізналися:
ПЕРЕВІРТЕ СВОЇ ЗНАННЯ
1. IIa скількох енергетичних рівнях розташовані електронні орбіталі в атомах Калію? Фосфору? Бору? Гелію?
2. Яка форма орбіталей у електронів, які перебувають на першому енергетичному рівні? на другому? на третьому?
3. Який підрівень заповнюється першим:
2s або 2р‘і Ss або 2р?
2s або 1.$? 3s або Зр?
4. До якої електронної родини належать елементи: Літій, Нітроген, Аргон, Гелій, Флуор, Кальцій?
ВИКОНАЙТЕ ЗАВДАННЯ
і. На зовнішньому енергетичному рівні в атомі Карбону є: а) два електрони; б) чотири електрони; в) шість електронів.
Виберіть правильну відповідь. Поясніть ваш вибір.
і. Який енергетичний рівень заповнюється електронами в атомах елементів № 9, 12, 15? Як ви це визначили?
і. Запишіть електрон но-графічну й електронну формули для атомів елементів: Карбон, Оксиген, Неон, Натрій. При цьому по-кроково запишіть ваші дії.
і. Установіть відповідності між числом електронів на зовнішньому рівні й групою, в якій розташований елемент.
|
Число електронів на зовнішньому рівні |
Група |
 |
 |
5. Скільки енергетичних рівнів та яку загальну кількість електронів містить атом із зовнішнім енергетичним рівнем:
а) 2s1;
б) 2в22ря;
в) 3s23pe?
6. Що спільного в будові атомів елементів із порядковими номерами 4 і 10? Виберіть правильну відповідь:
а) кількість нейтронів;
б) загальна кількість електронів;
в) кількість електронів на зовнішньому рівні;
г) кількість енергетичних рівнів.
7. Напишіть електронну формулу елемента, який містить на Зр-під-рівні два електрони. Який це елемент?
8. В атомі елемента, є:
а) два енергетичних рівні, причому на останньому чотири електрони;
б) три енергетичних рівні, причому на останньому — один електрон;
в) три енергетичних рівні, причому на останньому — вісім електронів.
Назвіть ці елементи.
9. Укажіть розподіл електронів по рівнях і підрівнях і напишіть електронні конфігурації елементів:
а) Натрію й Літію;
б) Магнію й Хлору;
в) Гелію й Неону;
Що спільного в їхній будові й чим вони відрізняються?
10. Укажіть правильно записану електронну формулу для атома Кальцію:
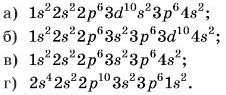
11. *В атомі елемента на 4р-підрівні два електрони. Що це за елемент? В якій групі, підгрупі, періоді він розташований? До якої електронної родини належить? Укажіть правильну відповідь.
а) Ti, TV група, побічна підгрупа, 4-й період;
б) Ge, IV група, головна підгрупа, 4-й період;
в) Ti, IV група, головна підгрупа, 4-й період;
г) Ge, IV' група, побічна підгрупа, 4-й період.
Це матеріал з підручника Хімія 8 клас Гранкіна
Автор: admin от 20-09-2016, 23:58, Переглядів: 7579