§ 5. Стан електронів у атомі. Електронні орбіталі. Енергетичні рівні та підрівні, їх заповнення електронами
За час вивчення атома дослідники пропонували багато теорій. в яких розглядали розташування електронів у атомі. На початку XX століття вважали. що електрони розташовані рівномірно навколо ядра й кожний електрон рухається по своїй орбіті, як космічні кораблі навколо Землі. У ті часи електрон вважали звичайною частинкою.
ЩО ТАКЕ «ЕЛЕКТРОН»?
Запропонована вченими квантово-механічна теорія будови атома припускала, що електрони і це дивно мають властивості хвилі й частинки одночасно.
— Щось я не розумію. Електрон має заряд і масу, тож це частинка!
— Hy то й що! Він також має властивості хвилі, наприклад, може огинати перешкоди, як світлова хвиля! Або хвиля на річці.
Я прочитала, що є такий вираз, який описує стан електрона: корпускулярно-хвильовий дуалізм! Корпускула це частинка, а дуалізм подвійність.
— Оце так! Довго вчила?
— Ага. Цілий вечір.
Через те що електрон поводиться як частинка та хвиля, для опису його поведінки використовують спеціальні складні рівняння, а вивченням руху електронів у атомах і молекулах займається спеціальна наука квантова хімія.
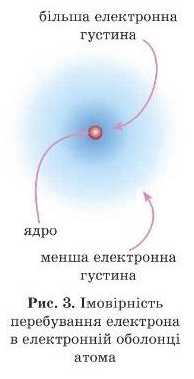
Однак найчастіше під час проведення досліджень хіміків не цікавить, по якій траєкторії та з якою швидкістю рухається електрон. їх цікавить, де в атомі або молекулі найімовірніше перебуває електрон. Ллє вказати точно, де перебуває електрон у певний момент часу, неможливо, як неможливо вказати, де перебувають фотони (частинки світла) у промені світла.
У тій частині атома, де електрон частіше буває, ймовірність зустрічі з ними зростає. І навпаки, в атомі є зони, де ймовірність перебування електрона мала.
..... ..... І
Імовірність перебування електрона в різних частинах електронної оболонки атома називають електронною густиною.
Іноді жартома говорять, що електрон «розмазаний» по електронній оболонці атома (рис. 3).
Що означає ймовірність перебування електрона в певній точці простору? Припустимо, що вам терміново знадобився директор школи. Куди ви підете? Полізете на горище ніколи? Пі, ви підете до кабінету директора. Чому? Там імовірність знайти директора найбільша. Якщо директора немає у своєму кабінеті, ви підете до вчительської. Там теж є ймовірність знайти директора. І там немає? Може, директор у тому кабінеті, де в нього заняття? Уф! Знайшли нарешті! От що виходить: імовірність знайти директора у своєму кабінеті 75 %, у вчительській 15 % ,
у навчальній кімнаті — 5%, у їдальні — 3%, на горищі — 0,0001 %. Чи будете ви його шукати на горищі?
Ми у процесі вивчення хімії будемо говорити про електрон іноді як про частинку, а іноді як про хвилю, залежно від того, що краще дозволить нам пояснити навчальний матеріал.
Для запису «розташування» електронів у атомі існують спеціальні електронні й електронно-графічні формули. Щоби грамотно й правильно вміти їх записувати, нам потрібно вивчити деякі поняття.
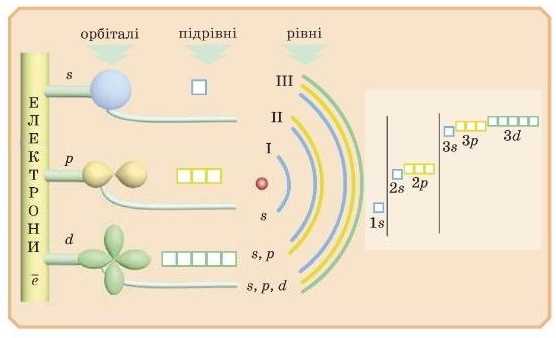
1. Електронна орбіталь і електронна хмара
Простір біля ядра, в якому можна виявити електрон із найбільшою ймовірністю, називають електронною орбіта ллю.

Ще для електронної о рб і талі використовують гарну назву електронна хмара.
Зазвичай на рисунку окреслюють ділянку атома, де ймовірність знайти певний електрон більше 90% (рис. 4). Орбіталь приймає вигляд кульки, гантелі або квіточки. Від чого це залежить, розглянемо далі.
Отже, в атомі електронні орбіталі мають різну форму й різний розмір. Залежно від їхньої енергії електрони можуть траплятися в різних частинах електронної оболонки атомів, або, інакше кажучи, перебувати на різних орбіталях.
Чому на різних орбіталях?
Чому така нерівність?
А хіба в школі не так? Директора частіше можна зустріти у своєму кабінеті, учителя хімії у кабінеті хімії, кухаря у шкільній їдальні, охоронця біля входу. Звичайно, всі ці «шкільні електрони* можуть переміщатися в одних і тих самих коридорах, але ймовірність знайти їх є великою тільки в певних місцях. «Шкільні електрони* займають різні «шкільні орбіталі».
Електрони, які мають високу енергію, можуть більше віддалятися від ядра. їхні орбіталі більші за розміром. Електрони з меншою енергією не можуть протистояти притяганню ядра їхні орбіталі розташовані ближче до ядра.
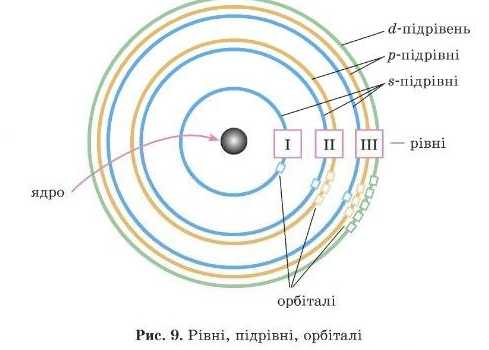
2. Енергетичні рівні
Орбіталі близьких за енергією електронів перебувають приблизно в одній і тій самій ділянці простору й утворюють енергетичні рівні, або електронні шари.
Отже, електрони з різною енергією перебувають на різних електронних шарах (або енергетичних рівнях) електронної оболонки (рис. 5).
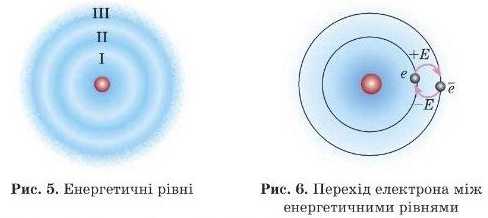
Таким чином, електронні орбіталі формують електронні шари, й електрони з меншою енергією розташовані ближче до ядра. Електрон може перейти на орбіталі більш віддаленого від ядра
електронного шару (на рівень вище), але для цього він має одержані додаткову енергію, наприклад, під час зіткнення або поглинання світла. Такий етан електрона називають збудженим. Електрон може й опуститися на рівень нижче, якщо там, звичайно, є «вільне місце», але при цьому він має віддати зайву енергію, наприклад, шляхом випромінювання світла (рис. 6‘).
Як визначити, скільки енергетичних рівнів формують електронні орбіталі в атомі певного елемента? Нам допоможе Періодична система.
Кількість енергетичних рівнів у атомі елемента дорівнює номеру періоду в Періодичній системі, в якому цей елемент перебуває.
/
Приклад
Подивіться в Періодичну систему Д. І. Менделєєва, (’пробуємо визначити кількість енергетичних рівнів у атомі Гідрогену. Цей елемент розташований у 1-му періоді, отже, у його атомі... тільки один енергетичний рівень. А скільки рівнів у атомах Літію, Берилію, Бору? По... два. В атомах Алюмінію, Силіцію, Фосфору по... три. Все дуже просто.
L=___
Можна розрахувати максимальне число електронів на будь-якому рівні. Для цього існує формула.
Якщо номер енергетичного рівня позначити літерою п, то максимальну кількість електронів N на цьому рівні обчис-л юють за формулою N = 2п .
Завдання
А тепер самостійно розрахуйте максимальне число електронів на другому, третьому та четвертому рівнях.
Відповідь: 8, 18 і 32 відповідно.
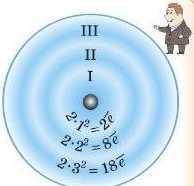
Приклад
Наприклад, для першого неріо-ду N = 2·I2 = 2, тобто максимальна кількість електронів на першому енергетичному рівні дорівнює 2.
3. Підрівні
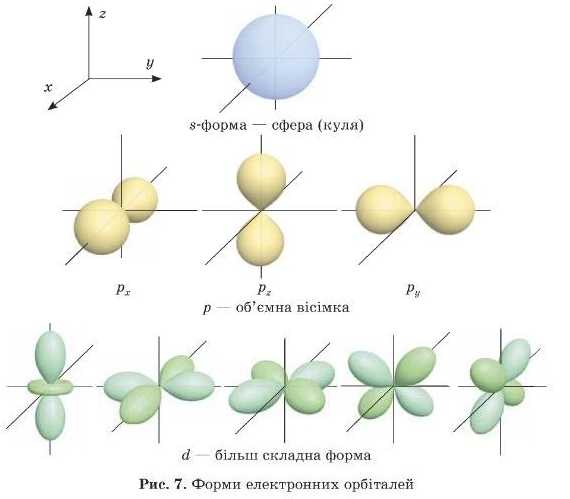
Як ми вже говорили раніше, електронні орбіталі можуть мати різну форму. Зазвичай різні форми орбіталей позначають літерами — я, р, d, / {рис. 7). Найбільш енергетично вигідна s-форма.
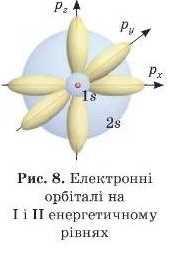
Електрони з однаковою енергією та формою електронних орбіталей утворюють підрівні, які також називають S-у p-у d- або /-підрівиями.
Відповідно, електрони, які займають ці підрівні, називають s-,ρ-, d-r /-електронами. Кількість підрівнів на кожному рівні (азначить, і кількість форм орбіталей) дорівнює номеру цього рівня. Тобто на першому рівні один иідрівень. Це найбільш енергетично
вигідний .s-підрівень; на другому рівні два підрівні: S- і д-підрівні, на третьому s-, д-, (/-підрівні тощо (рис.9).
4. Як розташовані орбіталі на підрівнях
ІЦе раз звернемося до рис. 7. У .s-електронів у тривимірній системі координат є всього одна можливість розташування електронної хмари в просторі: рівномірно по всіх осях це ж куля. Отже, на «-підрівні тільки одна орбіталь. В електронно-графічних формулах цю орбіталь позначають одним квадратиком [_).
У д-електронів електронні хмари можуть бути розташовані й по осі X, і по осі у, і по осі Zy {рис. 7), тобто існує три можливості розташування цих електронів у просторі.
Тому на д-нідрівні в електронно-графічних формулах малюють три клітинки I 1 1 І й говорять, що д-підрівень складається з трьох д-орбіталей. Для (/-електронів існує п’ять можливих розташувань d-орбіталей І І . 1 1 Ί. Узагальнимо отримані знання на рис. 8 і 9.
Заряди позначають знаками + і а спін
стрілочками
T і і.
5. Спін
В електронів, крім заряду, є ще одна властивість, яка .має назву спін. У старших класах вам про це розкажуть на уро-ках фізики. Λ зараз давайте запам’ятаємо, що в електронів буває два різних спіни, які позначають стрілкою: T або 1.
Електрон на схемах позначають стрілкою, що вказує його спін.
IIa одній і тій самій орбіталі можуть перебувати одночасно два електрони, але «уживаються» разом тільки ті, в яких різний спін.
На одній орбіталі не може перебувати більше двох електронів, і вони мають бути з протилежно направленими спінами.

Якщо електронами заповнюється р-підрівень, в якого три орбіталі, то розподіл електронів відбувається таким чином: спочатку в кожну клітинку пишуть по одному електрону:

Потім, під час подальшого заповнення, дописують у кожну клітинку по другому електрону з протилежним спіном:

6. Число електронів на зовнішньому (останньому) рівні
Кількість електронів на зовнішньому рівні електронної оболонки атома елемента головної підгрупи дорівнює номеру групи, в якій розташований цей елемент.
Приклад
Елемент Калій розташований у І групі, і на зовнішньому рівні в нього один електрон; Неон розташований у VIII групі, на зовнішньому рівні в нього вісім електронів.
ч
Завдання
Скільки електронів на зовнішньому рівні в атомах таких елементів: Натрій, Алюміній, Фосфор, Хлор?
Відповідь: 1, 3, 5, 7 відповідно.
7. Радіус атома
Невизначеність положення електрона в атомі не дозволяє чітко провести межі атома, тобто визначити його радіус.
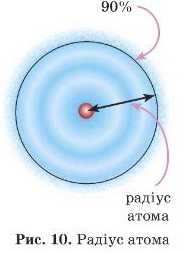
Вважають, що атом має форму сфери (кулі) певного радіуса, в якій міститься переважна частина електронної густини (порядку 90%).
Все це слід ураховувати для визначення розташування електронів у атомі. Насправді це не дуже складно, якщо виконувати таку роботу не поспішаючи.
Узагальнимо:
ПЕРЕВІРТЕ СВОЇ ЗНАННЯ
1. Які властивості виявляє електрон?
2. Які форми орбіта лей ви знаєте?
3. Чи можна чітко визначити радіус атома? Чому? Як його визначають?
4. Як визначити, скільки рівнів у атомі певного елемента?
5. Як змінюється енергія електронів на різних електронних шарах у атомі? На якому з них перебувають електрони з меншою енергією?
6. Чи можуть електрони підніматися на рівень вище? За якої умови?
7. Як визначити максимальне число електронів на певному рівні?
8. Які підрівні ви знаєте? Яку форму мають орбіталі на цих під-рівнях?
9. Скільки орбіталей на s-підрівні? на р-гіідрівні?
10. Скільки електронів може бути на одній орбіталі р-иідрівня? на всьому р-підрівні?
ВИКОНАЙТЕ ЗАВДАННЯ
1. Кількість електронів на зовнішньому рівні дорівнює:
а) нуклон йому числу;
б) порядковому номеру елемента;
в) номеру групи;
г) номеру періоду.
2. Дано числа:
а) 3; в) 12; д) 10.
б) 16; г) 5;
✓ Яке із цих чисел дорівнює нуклонному числу атома Окси-гену?
✓ Яке із цих чисел дорівіпос загальній кількості електронів у атомі Літію?
✓ 51 кс із цих чисел дорівнює кількості електронів на зовнішньому рівні атома Фосфору?
·/ Яке із цих чисел дорівнює кількості нейтронів у атомі Натрію?
3. На зовнішньому енергетичному рівні атома Карбону є:
а) два електрони;
б) чотири електрони;
в) шість електронів.
Виберіть правильну відповідь. Поясніть ваш вибір.
4. Який енергетичний рівень складається лише:
а) із s-підрівня;
б) із S-, р-підрівнів;
в) із 8-, р , (і-підрі вні в?
5. Яка максимальна кількість електронів може міститися на одній орбіталі? Обчисліть максимальну кількість електронів на 8-, р-, rf-підрівнях.
Це матеріал з підручника Хімія 8 клас Гранкіна
Автор: admin от 20-09-2016, 23:58, Переглядів: 4029