§ 2. Періодичний закон Д. І. менделєєва. Структура періодичної системи хімічних елементів

«А між тим кожен із нас розуміє, що за всієї зміни у властивостях простих тіл у вільному стані щось залишається постійним, і під час переходу елемента в сполуку... У цьому відношенні досі відомо тільки одне числове дане — атомна вага, властива елементу... Ось із цієї причини я й намагався заснувати систему на величині атомної ваги» (Д. І. Менделєєв).
ПЕРЕДІСТОРІЯ
Періодичний закон був відкритий Д. І. Менделєєвим під час роботи над текстом підручника «Основи хімії», коли він стикнувся з труднощами систематизації фактичного матеріалу. До середини лютого 1869 року, обмірковуючи структуру підручника, він поступово дійшов висновку, що між властивостями й атомними масами елементів існує якась закономірність.
Д. І. Менделєєв насамперед об’єднав у групи елементи, які утворюють подібні за своїми властивостями прості речовини. Утворилися дві групи: лужні метали і галогени.
Хімічні елементи, які утворюють лужні метали, зараз розташовані в І групі: Li, Na, К, Rb, Cs, Fr.
Це найбільш активні метали. Вони настільки активні, що можуть зайнятися на повітрі. Тому їх зберігають під шаром гасу або мінеральної олії. В усіх сполуках вони одновалентні, їх оксиди проявляють типово основні властивості й унаслідок взаємодії з водою утворюють основи.
Елементи, які утворюють галогени, займають зараз VII групу: F, Cl, Br, I, At.
Це найбільш активні неметали. Вони реагують із металами часто вже за звичайних умов. У результаті реакції утворюються солі. Звідси й назва: галогени — «ті, що породжують солі».
Але як включити їх у єдину систему, знайти взаємозв’язок між ними? Він почав складати групи елементів за порядком зміни їхніх хімічних властивостей і атомних мас. Елементи вишиковувалися у вертикальні стовпці й горизонтальні рядки, в яких чітко простежувалася певна закономірність.
ПЕРШИЙ ВАРІАНТ ПЕРІОДИЧНОЇ СИСТЕМИ
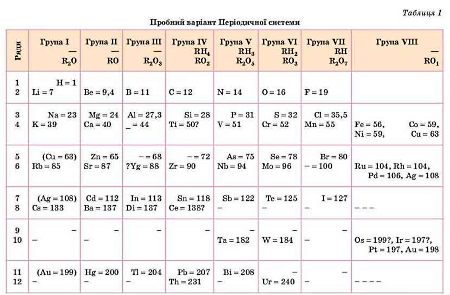
«Днем народження» Періодичної системи Д. І. Менделєєва зараз вважають 18 лютого 1869 р. У цей день Менделєєв склав перший варіант таблиці, названий ним «Досвід системи елементів, що ґрунтується на їхній атомній вазі й хімічній подібності», і розіслав його кільком відомим хімікам. Йдеться про завершальний день відкриття, над яким Д. І. Менделєєв працював близько 15 років. Якщо ви вважаєте, що вчений у результаті одержав добре знайому вам таблицю «Періодична система хімічних елементів», то помиляєтеся. Ось яку таблицю представив Д. І. Менделєєв:

У цьому варіанті Періодичної системи 63 елементи розташовані за порядком збільшення їхніх атомних ваг (зверху вниз і зліва направо). Розташування елементів у системі відбиває, як писав Д. І. Менделєєв, «виразну періодичність властивостей». Це був принципово новий і несподіваний висновок, тому що хіміки, які займалися класифікацією елементів до Д. І. Менделєєва, відзначали лише лінійну, послідовну зміну властивостей елементів у подібних групах. Уперше йдеться про періоди, а не тільки групи.
ПЕРІОДИЧНА ЗМІНА ВЛАСТИВОСТЕЙ ЕЛЕМЕНТІВ
Продовжуючи завзято працювати над розв’язанням суперечливих питань, усуненням протиріч і невідповідностей у розташуванні елементів, Д. І. Менделєєв складає нові варіанти таблиці. Він ураховує склад оксидів елементів та їх сполуки з Оксигеном і доходить висновку, що чим більше атомів Оксигену приєднує атом елемента, тим з меншим числом атомів Гідрогену він з’єднується:
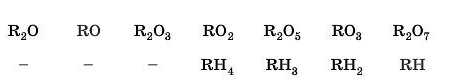
Ці загальні формули вищих оксидів і летких сполук з Гідрогеном ви можете бачити в сучасних варіантах Періодичної системи. Замість R можна підставити символ будь-якого хімічного елемента цієї групи. Наприклад, R2O5 — вищий оксид для елементів V групи. Відповідно, формули оксидів елементів будуть такими: N2O5, P2O5, As2O5 і т. д. Те саме й із водневими сполуками. Наприклад, для елементів V групи формули будуть такими: NH3, PH3, AsH3 іт. д.
Д. І. Менделєєв відмітив, що під час просування по періоду зліва направо властивості оксидів змінюються від основних до кислотних. Кожний період починається з металічного елемента (лужного металу). Потім, зі збільшенням порядкового номера елемента в періоді (зліва направо), металічні властивості елементів слабшають, а неметалічиі — посилюються. У сьомій групі найактивніші неме-талічні елементи — галогени. І так у кожному періоді.
Чому так відбувається, ми розглянемо трохи пізніше. Однак це є переконливим доказом періодичної зміни властивостей елементів і їх сполук.
НОВИЙ ВАРІАНТ ПЕРІОДИЧНОЇ СИСТЕМИ
1871 р. Д. І. Менделєєв у статті «Періодична закономірність хімічних елементів» опублікував новий варіант Періодичної системи, в якій було вказано знайдені ним закономірності.
У цій самій статті Д. І. Менделєєв наводить формулювання періодичного закону:
«Властивості елементів, а тому і властивості утворених ними простих і складних тіл перебувають у періодичній залежності від їхньої атомної ваги».
Формою відображення Періодичного закону є таблиця «Періодична система хімічних елементів».
= ДІЗНАЙТЕСЯ БІЛЬШЕ
Д. І. Менделєєв передбачив 11 іще невідомих на той час елементів. Відносно трьох із них — екабору, екаалюмінію й екасиліцію (умовні символи яких Eb, Еа, Es) — у нього була особливо тверда впевненість у можливості їх відкриття.
У період між виходом у світ другого (1872р.)і третього (1877 р.) видань книги «Основи хімії» передбачення Д. І. Менделєєва підтвердилися. Французький хімік Лекок де Буабодран 1875 р. відкрив новий елемент — Галій, властивості якого, встановлені експериментально, разюче збіглися з властивостями передбаченого екаалюмінію.
— І ви ще думаєте, що Менделєєву Періодична система просто наснилася?
Наприкінці 1879 р. шведський учений Нільсон відкрив передбачений Д. І. Менделєєвим екабор і назвав новий елемент Скандієм. 1886 р., коли німецький хімік Вінклер відкрив новий елемент — Германій, знову виявилося, що властивості, визначені для цього елемента дослідним шляхом, повністю збіглися з властивостями, зазначеними Менделєєвим для екасиліцію.
Після відкриття елемента Германію періодичний закон Д. І. Менделєєва одержав усесвітнє визнання, а Періодична система стала необхідним
і дуже важливим помічником кожного, хто займається хімією або вивчає її. Подальший розвиток хімії, відкриття нових елементів і вивчення їхніх властивостей призвели до різних доповнень і змін Періодичної системи. У середині XX століття Періодична система хімічних елементів набула сучасного вигляду.
Завдання
Порівняйте варіант Періодичної системи, зображений на табл. 1 із сучасним. Знайдіть відмінності.
СТРУКТУРА ПЕРІОДИЧНОЇ СИСТЕМИ ЕЛЕМЕНТІВ
За всю історію Періодичної системи було опубліковано більше 50 різних варіантів її зображення, найбільш популярними є корот-коперіодна й довгоперіодна форми.
На сьогодні в таблиці Періодичної системи є 118 відомих хімічних елементів (із порядковими номерами від 1 до 118).
Цікаво, що з них 94 виявлено в природі (деяких дуже мало), інші 24 отримано штучно в результаті ядерних реакцій, і в природі вони не існують.
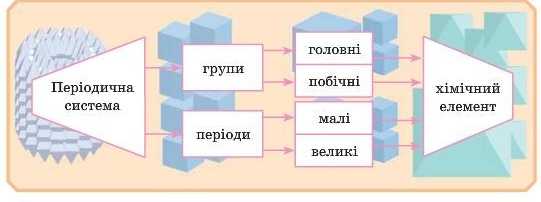
Головний принцип побудови Періодичної системи — виділення в ній періодів (горизонтальних рядів) і груп (вертикальних стовпців) елементів.
Завдання
Вкажіть елементи, ^ які розташовані:
а) у малих періодах;
б) у великих періодах.
Завдання
Знайдіть елементи головних і побічних підгруп у I, III, V групах.
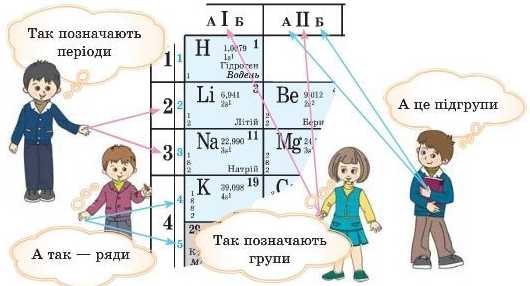
Сучасна Періодична система складається із семи періодів. Вони діляться на малі (I—III періоди) і великі (IV-VII періоди). У короткоперіодно-му варіанті Періодичної системи малі періоди складаються з одного ряду, а великі періоди — із двох рядів. Ko-роткоиєріодний варіант Періодичної системи містить вісім груп елементів, кожна з яких умовно поділяється на групу А (головну) і групу Б (побічну)
(див. форзаци).
У довгоперіодному варіанті Періодичної системи є 18 груп і немає розподілу на головну й побічну підгрупи. Кожний період складається з одного ряду, у великих періодах елементів більше.
Таблиці, у вигляді яких зображують довгоперіодний і коротко-періодний варіанти Періодичної системи, розділені на клітинки. У кожній клітинці зазначено: символ хімічного елемента, його назву, порядковий номер, відносну атомну масу. Можуть бути й інші дані.
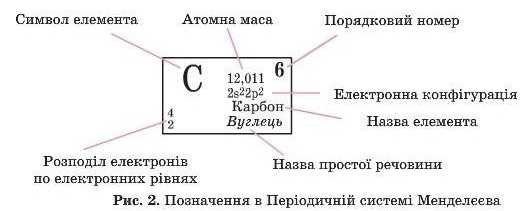
Періодична система описує будову атомів кожного елемента. Всі значення, які є в таблиці, характеризують або будову атомного ядра, або структуру електронної оболонки атома. Тому ми не зможемо зрозуміти періодичний закон, якщо не ознайомимося з тим, як улаштований атом. Ця тема в нас попереду.
Підіб'ємо підсумок:
ПЕРЕВІРТЕ СВОЇ ЗНАННЯ
1. Яку характеристику атома Д. І. Менделєєв поклав в основу свого закону?
2. У якій групі розташовані лужні метали? галогени?
3. У чому відмінність Періодичної системи Д. І. Менделєєва від інших класифікацій?
4. У чому полягає періодичність властивостей хімічних елементів?
5. Що називають періодом? групою?
6. Скільки груп і періодів у Періодичній системі?
7. Назвіть елементи II групи головної підгрупи; IV групи побічної підгрупи.
8. Назвіть елементи 2-го періоду. Це малий або великий період?
9. Знайдіть у Періодичній системі елемент Сульфур. Які відомості про цей елемент є в таблиці? Назвіть їх.
ВИКОНАЙТЕ ЗАВДАННЯ
У завданнях оберіть одну правильну відповідь.
1. Д. І. Менделєєв в основу періодичного закону — класифікації
хімічних елементів поклав:
а) зменшення розмірів атомних ядер елементів і хімічну схожість елементів;
б) збільшення атомних мас елементів і хімічну схожість елементів;
в) збільшення зарядів атомних ядер елементів і хімічну схожість елементів;
г) збільшення розмірів атомних ядер елементів і хімічну схожість елементів.
2. Кількість періодів у Періодичній системі:
а) 4; в) 8;
б) 5; г) 7.
3. Кількість груп у короткоперіодному варіанті Періодичної системи:
а) 10; в) 8;
б) 6; г) 7.
4. Елементи тільки головної підгрупи:
а) Be, Zn; в) С, Si;
б) Al, Sc; г) Cl, Mn.
δ. Елементи тільки побічної підгрупи:
а) Na, К; ' в) Р, V;
б) Al, In; г) Cr, Mo.
6. Виберіть найбільш активний неметалічний елемент:
а) В; в) С;
б) О; г) N.
7. Виберіть найбільш активний металічний елемент:
а) Al; в) К;
б) Mg; г) Na.
Це матеріал з підручника Хімія 8 клас Гранкіна
Автор: admin от 20-09-2016, 23:53, Переглядів: 3752