Узагальнення знань про неорганічні речовини
Матеріал параграфа допоможе вам:
• цілісно сприйняти класифікацію неорганічних речовин;
• усвідомити зв’язок між типом хімічного елемента і типами його сполук;
• переконатися в тому, що сполуки одного класу (однієї групи) мають аналогічну будову.
основи, кислоти, амфотерні сполуки, солі. Вам відомо, з яких частинок складаються різні неорганічні речовини, а також про типи хімічного зв’язку між цими частинками. Численні факти свідчать про те, що склад і будова речовин впливають на їхні фізичні та хімічні властивості.
Класифікація неорганічних речовин. Ви знаєте, що до неорганічних речовин належать прості речовини — метали і неметали, а також значна кількість складних речовин (крім сполук Карбону) (схема 15).
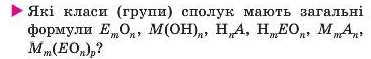
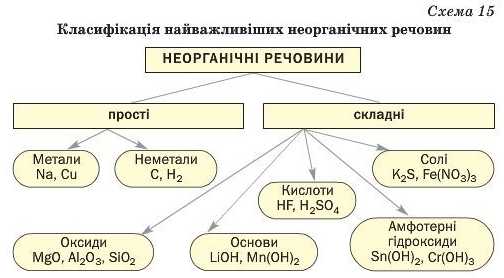
Оксиди — сполуки елементів з Оксигеном, у яких ступінь окиснення Оксигену становить —2. Хоча вони й подібні за складом, проте різняться за хімічними властивостями. Існують основні, кислотні й амфотерні оксиди. Усіх їх називають солетворними оксидами, бо ці сполуки перетворюються на солі, взаємодіючи з кислотами або основами (амфотерні оксиди реагують і з кислотами, і з основами). До утворення солей також призводять реакції цих оксидів з іншими оксидами.
Кілька оксидів (N2O, NO, CO, SiO, H2O) не виявляють ні основних, ні кислотних властивостей.
їхня загальна назва — несолетворні оксиди (схема 16).
Існує відповідність між типом елемента і типом його оксиду.
Металічні елементи можуть утворювати не лише основні та амфотерні оксиди, а й кислотні. Сполуки із загальною формулою M2O є основними оксидами. До оксидів цього типу належить і більшість сполук, склад яких відповідає формулі MO. Оксиди M2O3 і MO2 переважно є амфотерними, а сполуки M2O5, MO3 і M2O7 належать до кислотних оксидів.
Деякі металічні елементи утворюють оксиди всіх трьох типів. Так, для Хрому відомі основний оксид CrO, амфотерний — Cr2O3 і кислотний — CrO3. Як бачимо, зі зростанням ступеня окис-нення металічного елемента основні властивості його оксидів послаблюються, а кислотні властивості посилюються.
Неметалічні елементи утворюють кислотні й несолетворні оксиди.
Основні та амфотерні оксиди складаються з йонів, а кислотні та несолетворні — з молекул, іноді — з атомів.
Основи — сполуки, утворені йонами металічних елементів Mn 1 і гідроксид-аніонами ОН". Основи поділяють на розчинні у воді (їх називають лугами) і нерозчинні. Луги хімічно активніші за нерозчинні основи, які не реагують із солями, деякими слабкими кислотами і кислотними оксидами, а при нагріванні розкладаються.
Кислоти — сполуки, до складу молекул яких входять один або кілька атомів Гідрогену, здатних під час хімічних реакцій заміщуватися на атоми (йони) металічних елементів. Частину молекули кислоти — атом або групу атомів, що сполучені з атомом (атомами) Гідрогену, — називають кислотним залишком. Кислоти поділяють за складом на безоксигенові (HffA) та оксигеновмісні (Н„гі£Ол), на одно- і багато-основні, а за хімічною активністю — на сильні, слабкі і кислоти середньої сили.
Розрізняти луги і кислоти у розчинах допомагають речовини-індикатори (мал. 75).
Амфотерні гідроксиди — сполуки, подібні до основ за складом, але із двоїстим хімічним характером. Вони взаємодіють з кислотами як основи, а з лугами — як кислоти.
Мал. 75. Забарвлення індикаторів: у розчині кислоти (а), воді (б), розчині лугу (в)
Основні властивості в амфотерних гідроксидів виявляються краще, ніж кислотні. Наприклад, ферум(ІІІ) гідроксид Fe(OH)3 досить швидко взаємодіє з розбавленим розчином сильної кислоти, а з розбавленим розчином лугу реагує повільно й не зазнає повного перетворення.
Основи, амфотерні гідроксиди й оксигеновмісні кислоти іноді об’єднують у групу сполук, загальна назва яких — «гідрати оксидів» (тобто сполуки оксидів з водою1). Використовують також скорочену назву «гідроксиди». Підставою для цього є наявність у формулах сполук гідроксильних груп ОН. Якщо формули

1 Вода з грецької — hydor.
основ і амфотерних гідроксидів M(OH)n містять такі групи, то у формулах оксигеновмісних кислот HniEOn їх можна виокремити: H2SO4 =• =• SO2(OH)2.
Солі — сполуки, які складаються з катіонів металічних елементів і аніонів кислотних залишків. Сіль є продуктом реакції між речовиною з основними властивостями і речовиною з кислотними властивостями.
Будова неорганічних речовин. Прості речовини складаються з атомів або молекул.Неметали мають атомну або молекулярну будову; атоми в цих речовинах, їхніх молекулах сполучені неполярними ковалентними зв’язками. Лише в інертних газах зв'язки між атомами відсутні.
Метали складаються з атомів, які розміщені дуже щільно. Електрони легко переходять від одних атомів до інших і зумовлюють у речовині так званий металічний зв’язок. Рухливі електрони надають металам здатність проводити електричний струм, спричиняють особливий («металічний») блиск, високу теплопровідність.
Складні неорганічні речовини мають йонну, молекулярну, іноді — атомну будову.Із йонів складаються основні та амфотерні оксиди, основи, солі.
► Запишіть формули катіонів і аніонів, які містяться в кожній із таких сполук: K2O, Ba(OH)2, MgS, Ca3(PO1)2, Cr(NO3)3.
Кислотні та несолетворні оксиди, а також кислоти мають молекулярну будову. Оскільки в молекулах цих речовин сполучені один з одним атоми різних елементів, ковалентні зв’язки в них є здебільшого полярними.
► Зобразіть графічні формули молекул Cl2O і HClO3. Покажіть стрілками у цих формулах зміщення електронних пар ковалентних зв’язків і вкажіть ступені окиснення всіх елементів.
До неорганічних речовин належать прості речовини (метали, неметали), а також багато складних речовіш, які поділяють на класи. Найважливішими класами неорганічних сполук є оксиди, основи, кислоти, амфотерні гідроксиди, солі.
За хімічними властивостями оксиди поділяють на солетворні та несолетворні, а солетворні оксиди — на основні, кислотні й амфотерні.
Прості речовини складаються з атомів або молекул, а складні неорганічні речовини — з молекул або йонів.
296. Заповніть таблицю, записавши у відповідні колонки формули оксидів Li2O, Ag2O, CI2O7, MgO1 PbO, AI2O3, SiO2, ZnO, SO2, CrO3:
|
Оксиди |
||
|
— основні — |
амфотерні |
кислотні |
297. Знайдіть відповідність.
Формула оксиду Тип оксиду
1) MnO; а) амфотерний;
2) MnO2; б) основний;
3) Mn2O7; в) несолетворний;
г) кислотний.
298. Назвіть частинки, з яких складаються оксиди Кальцію, Алюмінію, Карбону.
299. Наведіть по одному прикладу кислот, молекули яких містять два, три, чотири, п’ять, шість, сім і вісім атомів.
300. Запишіть хімічні формули відомих вам амфотерних гідроксидів і вкажіть над символами металічних елементів їхні ступені окис-нення.
ЗОЇ. Виберіть у наведеному переліку формули солей і поясніть свій вибір: Pbl2, MgF2, PBr3, CH4, Na2S, CIF.
302. Співвідношення мас Силіцію, Оксигену та Гідрогену в сполуці, утвореній цими елементами, становить 7:16:1. Виведіть хімічну
формулу сполуки. До якого класу неорганічних сполук вона належить і чому?
303. Який об’єм газу хлороводню потрібно розчинити за нормальних умов віл води, щоб виготовити хлоридну кислоту із масовою часткою HCI 20 %?
Це матеріал з підручника Хімія 8 клас Попель
Автор: admin от 19-09-2016, 01:59, Переглядів: 3770