Властивості та використання солей
Матеріал параграфа допоможе вам
• з’ясувати фізичні властивості солей;
• засвоїти хімічні властивості солей;
• прогнозувати можливість реакції солі з металом;
• дізнатися про сфери використання солей.
Фізичні властивості солей. Солі, як і інші йонні сполуки, за звичайних умов є кристалічними речовинами. Вони здебільшого мають високі температури плавлення:
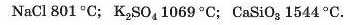
Частина солей розчиняється у воді, деякі є малорозчинними (мал. 63), решта — нерозчинні. Відповідну інформацію подано в таблиці розчинності (форзац II).

Приготування розчинів солей часто супроводжується тепловими ефектами. Наприклад, при розчиненні натрій карбонату виділяється невелика кількість теплоти і розчин трохи нагрівається. А під час утворення розчину натрій нітрату можна зафіксувати незначне зниження температури.
Серед розчинних солей натрій хлорид має солоний смак, магній сульфат — гіркий. Солі Плюмбуму і Берилію солодкі, проте надзвичайно отруйні. Виявляючи смак різних солей, деякі алхіміки, напевно, поплатилися за це життям.
Солі можуть по-різному впливати на рослини, тварин, людину. Серед них є сполуки, що містять необхідні для рослин елементи. їх застосовують як добрива. Кухонну сіль ми щоденно вживаємо разом із їжею, щоб поповнити її запаси в організмі (ця сполука постійно виводиться з організму разом із потом і сечею).
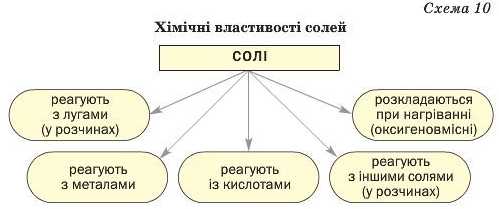
Хімічні властивості солей. Солі беруть участь у різних реакціях із простими і складними речовинами.
Реакції з металами. Сіль у водному розчині може реагувати з металом з утворенням нової солі та іншого металу (мал. 64). Часто кажуть, що один метал «витісняє» інший із солі. Реакція відбувається, якщо метал-реагент активніший за метал-продукт, тобто знаходиться в ряду активності зліва від нього (форзац II):
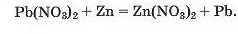

ЛАБОРАТОРНИЙ ДОСЛІД № 6 Взаємодія металів із солями у водному розчині
У пробірку обережно помістіть чистий залізний цвях і налийте трохи розчину купрум(ІІ) сульфату. Що відбувається на поверхні металу? Чи змінюється з часом колір розчину?
Складіть рівняння реакції. Візьміть до уваги, що один із її продуктів — сполука Феруму(ІІ).
Вивчаючи хімічні властивості лугів і кислот, ви дізналися про реакції цих сполук із солями. Крім того, солі також здатні взаємодіяти одна з одною. Всі згадані реакції належать до реакцій обміну.
Реакції з лугами.. Реакція між сіллю і лугом відбувається лише в розчині (нерозчинні солі з лугами не взаємодіють). Вона можлива, якщо один із її продуктів — основа чи сіль — є нерозчинним у воді (мал. 65):

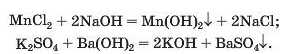
Для прогнозування можливості таких реакцій використовують таблицю розчинності.
ЛАБОРАТОРНИЙ ДОСЛІД № 7 Взаємодія солей із лугами у водному розчині
Налийте в пробірку трохи розчину купрум(ІІ) сульфату і додайте до нього при перемішуванні кілька крапель розчину натрій гідроксиду. Що спостерігаєте? Яка сполука осаджується?
Якщо до розчину купрум(ІІ) сульфату додати стільки розчину лугу, скільки потрібно для повного перетворення солі на купрум(ІІ) гідроксид, то після відстоювання розчин над осадом буде безбарвним. Він міститиме лише натрій сульфат (йони Na- і SOj-).
Складіть рівняння реакції.
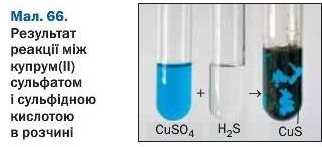
Реакції з кислотами. Сіль (як розчинна, так і нерозчинна) може взаємодіяти з кислотою з утворенням нової солі й нової кислоти. Такі реакції часто відбуваються з виділенням осаду (мал. 66) або газу
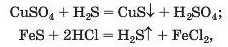
а іноді не супроводжуються зовнішнім ефектом:
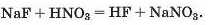

Випадки, у яких реакція між сіллю і кислотою є можливою, вказано в § ЗО.
Реакції з іншими солями. Взаємодія між двома солями відбувається лише в розчині (реагенти мають бути розчинними у воді) з утворенням двох нових солей. Реакція можлива, якщо один із її продуктів є нерозчинним або малорозчинним; він випадає в осад (мал. 67):
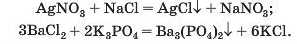
ЛАБОРАТОРНИЙ ДОСЛІД № 8 Реакція обміну між солями в розчині
Налийте в пробірку трохи розчину натрій карбонату і додайте до нього кілька крапель розчину кальцій хлориду. Що спостерігаєте?
Складіть рівняння реакції.
Термічний розклад солей. Оксигеновмісні солі, утворені газуватими, леткими чи нестійкими оксидами, при нагріванні розкладаються. Продуктами більшості таких реакцій є два відповідні оксиди:
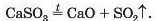
Нітрати, як і нітратна кислота, походять від нітроген(У) оксиду N2O5. Однак під час нагрівання нітратів цей оксид не утворюється через свою нестійкість:
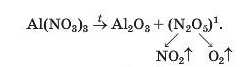
Солі лужних елементів або не розкладаються під час нагрівання (карбонати, сульфати), або їхній розклад має певні особливості. Деякі з таких реакцій використовують у лабораторії для добування кисню:
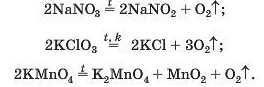
Викладений матеріал підсумовує схема 10.
Використання солей. Багато солей має різноманітне застосування. Натрій хлорид є сировиною в хімічній промисловості для добування хлору, хлоридної кислоти, натрій гідроксиду, соди. Ця сполука незамінна під час приготування їжі, консервування. Хлорид, сульфат, нітрат Калію, фосфати Кальцію, деякі інші солі є мінеральними добривами (мал. 68). Кальцій карбонат у вигляді каменю вапняку використовують у будівництві, а на заводах із нього виробляють вапно. На основі штучно добутої солі CaCO3 виготовляють зубну пасту. У школі пишуть на дошці крейдою, а це — також кальцій карбонат. 25

Кальцій сульфат (гіпс) застосовують у будівництві та медицині. Простим засобом для миття і чищення посуду, предметів домашнього вжитку є кальцинована сода, або натрій карбонат. Кальциновану соду разом із крейдою або вапняком використовують для виробництва скла.
Солі — йошгі речовини. Вони мають високі температури плавлення, різну розчинність у воді.
Солі взаємодіють з металами з утворенням іншої солі та іншого металу. Такі реакції відбуваються, якщо метал-реагент активніший за метал-продукт (це визначають за рядом активності металів).
Солі вст^тіають у реакції обміну з лугами, кислотами, іншими солями. Деякі оксигено-вмісні солі при нагріванні розкладаються на відповідні оксиди.
Багато солей використовують на практиці.
253. Охарактеризуйте фізичні властивості солей. Наведіть приклади розчинних, малорозчинних і нерозчинних у воді солей.
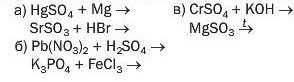
254. Допишіть схеми реакцій і складіть хімічні рівняння:
255. Замість крапок напишіть формули солей і перетворіть схеми реакцій на хімічні рівняння:
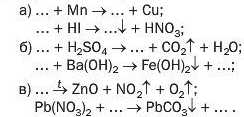
■ ~ν·~3/2 ■ ··· ' ■ ---з· .....
256. Напишіть рівняння реакцій (якщо вони відбуваються) між такими сполуками:
а) калій силікатом і нітратною кислотою:
б) натрій сульфатом і магній нітратом;
в) купрум(ІІ) хлоридом і барій сульфатом;
г) хром(ІІІ) сульфатом і натрій гідроксидом;
г) калій сульфідом і меркурій(ІІ) нітратом.
257. Напишіть рівняння реакцій, за допомогою яких можна здійснити такі послідовні перетворення:
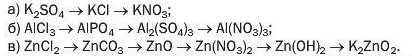
258. Яку максимальну масу ферум(ІІІ) фториду можна добути із 4,84 г ферум(ІІІ) нітрату? Як би ви здійснили такий експеримент?
259. Чи вистачить 13 г цинкового порошку для повного перетворення 33,1 г плюмбум(ІІ) нітрату на свинець?
260. Після занурення залізної пластинки у розчин купрум(ІІ) сульфату її маса збільшилася на 0,8 г. Обчисліть масу міді, що виділилася на пластинці.
261. У результаті нагрівання 28,7 г суміші нітратів Натрію і Калію добули 3,36 л кисню (н. у.). Які маси солей містились у вихідній суміші?
Г Λ
для допитливих
Кислі солі
Ви знаєте, що під час реакції кислоти з лугом атоми Гідрогену кожної молекули кислоти «замінюються» на атоми (точніше — йони) металічного елемента:
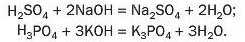
А чи можливо, щоб у молекулі багатоосновної кислоти відбулася заміна лише частини атомів Гідрогену? Так. У результаті відповідних реакцій утворюються так звані кислі солі:
Кислі солі Ca(HCO3)2 і Mg(HCO3)2 містяться в розчиненому стані у прісній воді. При її кип’ятінні сполуки розкладаються
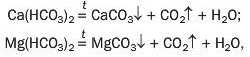
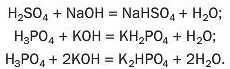
і на стінках посудини утворюється накип — суміш карбонатів CaCO3 і MgCO3.
Кислі солі Кальцію й ортофосфатної кислоти CaHPO4 і Ca(H2PO4)2 становлять основу фосфорних добрив — преципітату і суперфосфату відповідно. Кисла сіль Натрію і карбонатної кислоти NaHCO3 відома кожній домогосподарці; це — питна (харчова) сода (мал. 69).

ПРАКТИЧНА РОБОТА № 1 Дослідження властивостей основних класів неорганічних сполук
ВАРІАНТІ
Дослідження хімічних властивостей хлоридної кислоти
ДОСЛІД 1
Дія хлоридної кислоти на індикатор
За допомогою піпетки або скляної палички нанесіть краплю розбавленої хлоридної кислоти на універсаль-
ний індикаторний папірець. Як змінюється його забарвлення?
ДОСЛІД 2
Реакція хлоридної кислоти з металом
У пробірку обережно помістіть гранулу цинку і долийте 1 мл розбавленої хлоридної кислоти. Вміст пробірки можна трохи підігріти. Що спостерігаєте?
ДОСЛІД З
Реакція хлоридної кислоти
з оснбвним (амфотерним) оксидом
У пробірку насипте трохи магній оксиду (ферум(ІІІ) оксиду) й долийте 1 мл розбавленої хлоридної кислоти. (Для прискорення реакції між амфотерним оксидом і кислотою їхню суміш можна нагріти, але не до кипіння.) Які зміни відбуваються з речовинами?
ДОСЛІД 4
Реакція хлоридної кислоти
з лугом26
Налийте в пробірку 1 мл розбавленої хлоридної кислоти і додайте 1—2 краплі розчину фенолфталеїну. Доливайте до кислоти по краплях при перемішуванні розчин натрій гідроксиду до появи малинового забарвлення. Про що свідчить цей ефект?
ДОСЛІД 5
Реакція хлоридної кислоти із сіллю
Налийте в пробірку 1—2 мл розчину натрій карбонату і додайте 1—2 мл розбавленої хлоридної кислоти. Що спостерігаєте?
ВАРІАНТ Il
Дослідження властивостей нікель(ІІ) сульфату
ДОСЛІД 1
Дослідження фізичних властивостей нікель(ІІ) сульфату
Уважно розгляньте видану вам сіль Нікелю та опишіть її. Укажіть характер часточок сполуки (кристалики, порошок, кусочки довільної форми).
З’ясуйте, чи розчиняється нікель(ІІ) сульфат у воді. Для цього у невелику склянку з водою насипте приблизно 1/4 чайної ложки сполуки і перемішайте суміш скляною паличкою. Який результат досліду? Чи узгоджується він із даними, наведеними в таблиці розчинності?
Виготовлений розчин солі розподіліть по чотирьох пробірках.
ДОСЛІД 2
Реакція нікель(ІІ) сульфату з металом
У пробірку з розчином нікель(ІІ) сульфату помістіть гранулу цинку. Нагрівайте вміст пробірки протягом 1—2 хв., але не до кипіння. Чи змінюється поверхня металу, забарвлення розчину?
ДОСЛІД З
Реакція нікель(ІІ) сульфату з лугом
В іншу пробірку з розчином нікель(ІІ) сульфату додайте такий самий об’єм розчину лугу. Які зміни помічаєте?
ДОСЛІД 4
Реакції нікель(ІІ) сульфату із солями
В одну із двох пробірок із розчином нікель(ІІ) сульфату, які залишилися, додайте розчин натрій карбонату, а в другу — розчин барій хлориду. Що спостерігаєте?
Під час виконання кожного досліду записуйте в подану нижче таблицю свої дії, спостереження (фіксуйте розчинення речовини, утворення осаду, виділення газу, наявність чи відсутність запаху, появу чи зміну забарвлення тощо). Після завершення досліду запишіть у таблицю висновки і відповідні хімічні рівняння.
|
Послідовність дій |
Спостереження |
Висновкн |
|
Дослід 1. ... |
||
|
... |
... |
... |
|
Дослід 2____ |
||
|
... |
... |
... |
|
Рівняння реакції: ... |
||
|
Дослід 3.... |
||
262. Чи відбудеться реакція в досліді 2 кожного варіанта, якщо замість цинку взяти: а) магній; б) срібло? Відповіді обгрунтуйте.
263. Чи відбудеться реакція в досліді 5 (варіант І) або досліді 4 (варіант II), якщо натрій карбонат замінити: а) на кальцій карбонат; б) на натрій нітрат? Відповіді обгрунтуйте.
264. Реакції яких типів ви здійснювали під час виконання практичної роботи?
Це матеріал з підручника Хімія 8 клас Попель
Автор: admin от 19-09-2016, 01:57, Переглядів: 5920