Періодична система і хімічні властивості сполук
Матеріал параграфа допоможе вам:
• дізнатися, як змінюється характер вищих оксидів елементів у періодах і головних підгрупах;
• передбачати хімічні властивості вищих оксидів і гідратів цих оксидів за розміщенням елементів у періодичній системі;
• з’ясувати хімічні властивості найважливіших сполук елементів з Гідрогеном.
Оксиди. Сполуки цього типу утворюють майже всі хімічні елементи. Частина оксидів взаємодіє з водою, перетворюючись на основи
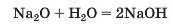
або кислоти
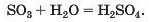
Оксиди, яким відповідають основи, називають основними (Na2O та ін.), а ті, яким відповідають кислоти, — кислотними (SO3 та ін.).
Найхарактернішими і найважливішими для елементів є вищі оксиди, у яких елемент виявляє максимально можливе для нього значення валентності; воно збігається з номером групи періодичної системи, в якій міститься елемент.
Простежимо, як змінюються властивості вищих оксидів залежно від розміщення елементів у періодичній системі.
Спочатку розглянемо вищі оксиди елементів 2-го періоду' (табл. 2). Перший елемент цього періоду — металічний Літій. Він утворює основний оксид Li2O. Другим є Берилій, теж металічний елемент. Оксид BeO має хімічні властивості, притаманні як основним, так і кислотним оксидам. Такі сполуки, як берилій оксид, називають амфотерними; їх докладно розглядатимемо в § 31.
|
Елемент |
Li |
Be |
В |
C |
N |
O |
F |
Ne |
|
Формула оксиду |
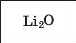 |
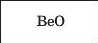 |
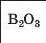 |
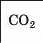 |
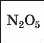 |
 |
 |
 |
|
Тип оксиду |
Основний |
Амфотерний |
Кислотний |
— |
||||
Інші елементи 2-го періоду є неметал іч-ними елементами. Бор, Карбон і Нітроген утворюють кислотні оксиди B2O3, CO2, N2O3. У перших двох сполук кислотні властивості виражені слабко, а у третьої — повною мірою.

Пояснимо, чому в таблиці 2 під символами Оксигену, Флуору і Неону містяться риски. Оксиду Оксигену, зрозуміло, не існує. Сполука OF2 до оксидів не належить (пояснення — на с. 124); її назва — оксиген фторид. Інертний елемент Неон не утворює жодної сполуки.
Кислотні властивості ВИЩИХ ОКСИДІВ ПОСИЛЮЮТЬС5І в
періодах зліва направо, а основні властивості — у протилежному напрямі.
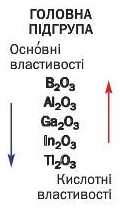
Властивості вищих оксидів у головних підгрупах кожної групи елементів також змінюються поступово. Для прикладу візьмемо оксиди елементів III групи (табл. 3).
Tаблиця З
Вищі оксиди елементів головної підгрупи III групи
|
Елемент |
Формула оксиду |
Тип оксиду |
|
В |
B2O3 |
Кислотний |
|
Al |
Al2O3 |
Амфотерний |
|
Ga |
Ga2O3 |
|
|
In |
In2O3 |
|
|
Tl |
Tl2O3 |
Основний — |
Основні властивості вищих оксидів посилюються в головних підгрупах згори донизу, а кислотні властивості — у протилежному напрямі.
► Зіставте властивості оксидів елементів головної підгрупи II групи. Чи підтверджується щойно зроблений висновок?
Гідрати оксидів. Продуктами реакцій оксидів з водою є основи або кислоти; їх спільна назва — гідрати оксидів. Значна кількість оксидів не взаємодіє з водою, але відповідні гідрати оксидів існують (їх добувають іншими способами). Якщо така сполука походить від основного оксиду, то вона є основою, якщо від кислотного — кислотою, а якщо від амфотерного оксиду — амфотерним гідроксидом:
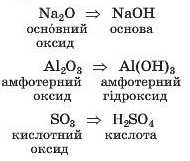
Очевидно, що зміни основних і кислотних властивостей гідратів оксидів у періодах і головних підгрупах мають бути такими самими, що й для оксидів.
Кислотні властивості гідратів оксидів посилюються в періодах зліва направо, а основні властивості — у протилежному напрямі.
Основні властивості гідратів оксидів посилюються в головних підгрупах згори донизу, а кислотні властивості — у протилежному напрямі.
Проілюструємо ці висновки відомостями про хімічний характер гідратів вищих оксидів елементів 2-го і 3-го періодів (табл. 4).
|
Періоди |
Групи |
||||||
|
І |
II |
ІП |
IV |
V |
VI |
VII |
|
|
2 |
 |
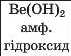 |
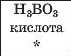 |
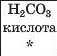 |
 |
 |
 |
|
3 |
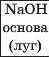 |
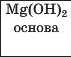 |
 |
 |
 |
 |
 |
Примітка. Однією зірочкою позначено малоактивні кислоти, двома — кислоту середньої активності, трьома — кислоти високої активності.
Сполуки елементів із Гідрогеном. Такі сполуки утворюють багато хімічних елементів. їхні будова і властивості неоднакові, вони змінюються в періодах і групах, але не так наочно, як для оксидів чи гідратів оксидів.
Розглянемо сполуки елементів 3-го періоду з Гідрогеном (табл. 5).
Перший елемент у цьому періоді — Натрій. Він утворює сполуку NaH (натрій гідрид), яка складається з йонів8. За будовою, деякими властивостями і навіть зовнішнім виглядом (біла кристалічна речовина) натрій гідрид нагадує натрій хлорид NaCl. Сполука Магнію, наступного елемента в періоді, має формулу MgH2. Це також йонна речовина. Сполука Алюмінію AlH3 складається з атомів. Силіцій і Фосфор перебувають у середині періоду. Силан SiH., і фосфін PH3 — гази, які майже не розчиняються у воді й не реагують із нею. Ці речовини складаються з молекул. Далі в періоді розміщені Сульфур і Хлор. Ix сполуки з Гідрогеном — сірководень H2S і хлороводень HCl — є молекулярними речовинами. Це — гази, які розчиняються у воді; їх розчини виявляють властивості, притаманні кислотам.
Tаблиця 5
Сполуки елементів 3-го періоду з Гідрогеном
|
Елементи |
Na |
Mg |
AI |
Si |
P |
S |
Cl |
Ar |
|
Формула сполуки |
NaH |
MgH2 |
AIH3 |
SiH1 |
PH3 |
H2S |
неї |
— |
|
Будова |
Йонна |
Атомна |
Молекулярна |
— |
||||
|
Агрегатний стан за звичайних умов |
Твердий |
Газуватий |
— |
|||||
Будова і властивості більшості сполук елементів 2-го періоду з Гідрогеном такі самі, що й аналогічних сполук елементів 3-го періоду. Літій гідрид LiH — йонна речовина, подібна до сполуки Натрію NaH. Метан CH1 — газоподібна молекулярна сполука, яка майже не розчиняється у воді (як і SiH1). Фтороводень HF — газ, який складається з молекул. Його водний розчин, як і розчин НС1, виявляє властивості, притаманні кислотам.
Проте дві сполуки елементів 2-го періоду з Гідрогеном — амоніак NH3 і вода H2O — істотно відрізняються від фосфіну PH3 і сірководню H2S. Амоніак хоч і газ, але його розчин за властивостями нагадує дуже розбавлений розчин лугу. А вода за звичайних умов — рідина; вона є оксидом, але не виявляє ні основних, ні кислотних властивостей.
Існує зв’язок між хімічними властивостями вищих оксидів, відповідних гідратів оксидів і розміщенням елементів у періодичній системі.
Основні властивості вищих оксидів і гідратів оксидів посилюються в періодах справа наліво, у головних підгрупах — згори донизу, а кислотні властивості — у протилежних напрямах.
Сполуки типових металічних елементів із Гідрогеном мають йонну будову, а сполуки типових неметалічних елементів із Гідрогеном складаються з молекул.
70. Чи містить періодична система інформацію про оксиди? Якщо так, то яку саме і який її варіант — довгий чи короткий?
71. У якої зі сполук основні (кислотні) властивості мають бути виражені яскравіше:

72. Напишіть формули вищих оксидів елементів 3-го періоду. Зіставте властивості цих сполук, використавши відомості про гідрати оксидів, наведені в параграфі. Складіть таблицю вищих оксидів елементів 3-го періоду, подібну до таблиці 2.
73. Поясніть наявність пропусків на початку рядка короткого варіанта періодичної системи, назва якого — «Леткі сполуки з Гідрогеном».
74. Запишіть формули сполук Кальцію з Гідрогеном і Арсену з Гідрогеном. Яка, на вашу думку, будова кожної сполуки — молекулярна, йонна?
75. Масова частка Гідрогену в сполуці з іншим елементом становить 10 %. Визначте елемент і обчисліть масову частку Оксигену в оксиді цього елемента.
Це матеріал з підручника Хімія 8 клас Попель
Автор: admin от 19-09-2016, 01:45, Переглядів: 5743