Періодична система, хімічний характер елементів і властивості простих речовин
Матеріал параграфа допоможе вам:
• з’ясувати, як змінюється характер елементів у періодах і головних підгрупах;
• передбачати хімічні властивості простих речовин та їх активність з урахуванням розміщення елементів у періодичній системі.
Хімічний характер елементів. Ви знаєте, що існують металічні та неметалічні елементи. Перші розміщені в періодичній системі на початку кожного періоду і в середині великих періодів. їхні атоми мають на зовнішньому енергетичному рівні, як правило, від одного до трьох електронів. Неметалічні елементи завершують періоди. Зовнішніх електронів у їхніх атомах більше — від 4 до 8:
|
Період |
Групи |
|||||||
|
І |
П |
III |
IV |
V |
VI |
VII |
VIII |
|
|
3 |
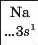 |
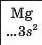 |
 |
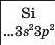 |
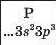 |
 |
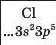 |
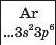 |
|
Металічні елементи |
Неметалічні елементи |
|||||||
Металічні елементи утворюють прості речовини метали, а неметалічні — прості речовини неметали. Хімічний характер елемента оцінюють передусім за хімічними властивостями його простої речовини, тобто враховують, чи вступає вона в реакції, характерні для металів або неметалів, а якщо вступає, то наскільки активно.
Хімічна активність металів — простих речовин елементів одного періоду. Зіставимо активність простих речовин металічних елементів 3-го періоду в реакціях з водою. Помістимо шматочок натрію у воду, в яку добавлено 1—2 краплі розчину індикатора фенолфталеїну. Відразу виділяється газ (це супроводжується шипінням), а метал унаслідок виділення теплоти під час взаємодії речовин плавиться, і його блискуча кулька «бігатиме» по воді (мал. 25), доки не зникне. Індикатор забарвлюється в малиновий колір, що свідчить про утворення лугу:
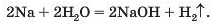
Магній вступає в аналогічну реакцію лише при нагріванні (мал. 26)
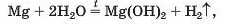
а алюміній навіть у киплячій воді залишається незмінним.

Отже, хімічна активність цих металів щодо води зростає від алюмінію до натрію.

Хімічна активність металів — простих речовин елементів головної підгрупи. Звернемо увагу на відношення до води трьох простих речовин елементів головної підгрупи II групи. Берилій не реагує з водяною парою навіть за досить високої температури, магній взаємодіє з гарячою водою, а кальцій вступає в реакцію з нею вже за звичайних умов.
► Складіть рівняння реакції кальцію з водою.
Дослідивши інші реакції за участю металів, можна виявити таку закономірність:
металічний характер елементів і хімічна активність металів посилюються в періодах справа наліво, а в головних підгрупах — згори донизу.
Ураховуючи цю закономірність, доходимо висновку: типові металічні елементи перебувають у лівому нижньому куті довгого варіанта періодичної системи. Це — Францій, Цезій, Радій.
Хімічна активність неметалів — простих речовин елементів одного періоду. Порівняємо особливості перебігу реакцій простих речовин неметалічних елементів 3-го періоду з воднем.
Силіцій не реагує з воднем, а фосфор вступає з ним у реакцію за температури понад 300 °С і підвищеного тиску:
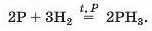
Сірка починає взаємодіяти з воднем за температури 120 °С:
Суміш хлору з воднем при освітленні вибухає (у темряві реакція не відбувається):
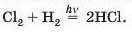
Якщо водень підпалити на повітрі, а потім трубку, по якій він проходить, опускати в посудину з хлором, то горіння триватиме (мал. 27).

Ці та інші факти свідчать про те, що активність названих неметалів зростає від силіцію до хлору.
Аналогічну зміну хімічної активності спостерігаємо для неметалів, утворених елементами 2-го періоду. Азот реагує з воднем при нагріванні й за наявності каталізатора (продукт реакції — амоніак NH3). CjfrMimi кисню і водню, а також фтору і водню BpjfrxaioTb; перша — при підпалюванні, друга — за звичайних JfrMOB і навіть у темряві.
Останні елементи періодів утворюють найпасивніші неметали; ці прості речовини, як вам відомо, називають інертними газами.
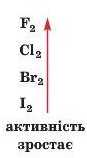
Хімічна активність неметалів — простих речовіш елементів головної підгрупи. Зіставимо перебіг реакцій із воднем галогенів — простих речовин елементів головної підгрупи VII групи.
Про реакції фтору і хлору з воднем ішлося вище; фтор виявляє більшу активність, ніж хлор. Бром взаємодіє з воднем лише при нагріванні й за наявності каталізатора
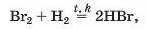
а реакція йоду з воднем
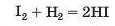

не відбувається повністю за будь-яких умов.
Отже, хімічна активність галогенів зростає від йоду до фтору.
Неметалічний характер елементів і хімічна активність неметалів посилюються в періодах зліва направо, а в головних підгрупах — знизу догори.
Типові неметалічні елементи перебувають у правому верхньому куті довгого варіанта періодичної системи. Це — Флуор, Хлор, Оксиген. Матеріал параграфа підсумовує схема 3.
Схема З
Зміна хімічного характеру елементів і активності простих речовин у періодичній системі {човгай кяпіянт. головні пііїгпупиі

Хімічний характер елемента зумовлений хімічними властивостями його простої речовини.
Металічний характер елементів і активність металів посилюються в періодах справа наліво, а в головних підгрупах — згори донизу. Немета-лічний характер елементів і активність неметалів посилюються в періодах зліва направо, а в головних підгрупах — знизу догори.
Типові металічні елементи перебувають у лівому нижньому KjTi довгого варіанта періодичної системи, а типові неметалічні елементи — у правому' верхньому куті.
66. У чому виявляється хімічний характер елементів?
67. Який елемент 4-го періоду утворює найактивніший метал, а який — найактивніший неметал? Назвіть порядкові номери цих елементів і номери груп, у яких вони розміщені.
68. Яка проста речовина має бути активнішою в хімічних реакціях: літій чи натрій, калій чи кальцій, сірка чи селен, телур чи йод?
69. Назвіть елементи, які завершують періоди. До якого типу елементів вони належать і які прості речовини утворюють? Що ви знаєте про здатність цих речовин до хімічних перетворень?
Це матеріал з підручника Хімія 8 клас Попель
Автор: admin от 19-09-2016, 01:44, Переглядів: 6526