§ 35. Фізичні та хімічні властивості солей
Опанувавши матеріал параграфа, ви зможете:
• пояснюватифізичні властивості солей;
• характеризуватихімічні властивості середніх солей;
• досліджувативзаємодію солей із металами, лугами; двох солей між собою;
• робити висновкипро фізичні й хімічні властивості середніх солей; висновки з експерименту.
Пригадайте визначення солей. Наведіть приклади середніх солей.
Фізичні властивості солей. Солі — тверді кристалічні речовини, що належать до йоиних сполук. За таблицею розчинності кислот, основ, солей та амфотерних гідроксидів у воді, неважко з’ясувати, що ці сполуки по-різному розчиняються у воді. Серед солей є розчинні, малорозчинні, нерозчинні у воді. їх розчини мають різне забарвлення (рис. 83). Так, солі Кунруму CuSO4 · SH2O сипі, Феруму(ІІІ) FeCl3 — жовті, біхромати K2Cr2O7 — оранжеві. Температури плавлення іі кипіння солей дуже високі.

Подумайте й скажіть, яку властивість кухонної солі використовують під час простудних захворювань.
Хімічні властивості середніх солей. Солі, як і інші класи неорганічних сполук, мають здатність вступати в хімічну взаємодію з простими й складними речовинами. Розглянемо властивості середніх солей.
1. Взаємодія розчинів солей із металами.
Працями М. Бекетова доведено, що метали проявляють різну хімічну активність. Тому в і>еакціях між металом і сіллю тільки активніший мсгга-т витіснить менш активний. Наприклад, якщо мідну монету покласти в розчин меркурій(II) нітрату, вона поступово покривається шаром ртуті, а мідь переходить в розчин:
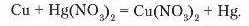
Дослідимо взаємодію солей з металами у процесі лабораторного досліду.
Лабораторний дослід 7
ВЗАЄМОДІЯ МЕТАЛІВ ІЗ СОЛЯМИ У ВОДНОМУ РОЗЧИНІ
Завдай ня 1. Дослідіть взаємодію розчинів солей з металами. Обладнання ύ реактиви: хімічні склянки; розчини солей: купрум(ІІ) сульфату, ферум(ІІ) сульфату, аргептум нітрату; залізний цвях, до якого прив'язана нитка; дві мідні пластини.
Увага! Повторіть правила безпеки під час роботи в кабінеті хімії та суворо дотримуйтесь їх.
Хід роботи
Дослід 1. Візьміть три хімічні склянки. У першу налийте кунрум(ІІ) сульфату; у другу ферум(ІІ) сульфату; у третю — аргентум (І) 11ітрату.
Опустіть у розчин, що в першій склянці, залізний цвях, прив’язаний до нитки (рис. 84 а). У другий і третій мідні пластини (рис. 84 6, в). Почекайте кілька хвилин.
Порівняйте результати досліду й опишіть спостереження.
Зробіть відповідні висновки.

Пояснимо отримані результати. У першому випадку па поверхні залізного цвяха з’являється червоний наліт. Це виділилася мідь. У другому випадку ;$ мідною пластиною не відбуваються жодні зміни. А під час занурення такої ж мідної пластини в розчин BpreiiTyM(T) нітрату на її поверхні осідає срібло. Отже, у першій і третій склянках відбулися реакції, а в другій ні.
Порівнявши активність металів, що вступають у реакцію, і тих, які входять до складу солей, можна зробити висновок: реакція відбувається тоді, коли метал є більш активним за той, що входить до складу солі.
Рівняння реакцій:
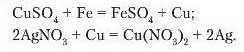
2. Взаємодія солей з кислотами.
Водні розчини солей реагують з кислотами, унаслідок чого утворюється нова сіль і нова кислота. Якщо до розчину нагрій
карбонату долити хлоридпої кислоти, то відбувається бурхливе виділення газу. Це свідчить проте, що реакція відбулася.
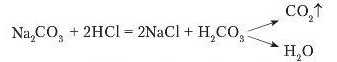
Про розпадання нестійкої карбонатної кислоти H2CO3 уже йшлося в §29 (с. 164). Однак не тільки карбонати взаємодіють з кислотами з виділенням газу. Під час доливання до розчину калій сульфіту нітратної кислоти теж спостерігається виділення газу. Це сульфур(ІУ) оксид.
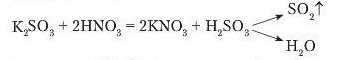
Як вам відомо, реакції відоуваються, коли під час їх перебігу випадає осад. Візьмемо розчин барій хлориду й подіємо розчином сульфатної кислоти. Спостерігається випадання білого осаду (див. с. 164, рис. 72).
Напишіть самостійно рівняння цієї реакції.

Ббкєтов Микола Миколайович (1827-1911) — український фізико-хімік. Розробив
теорію витіснення металів, встановив ряд активності металів, описав метод відновлення металів за допомогою алюмінію. Захистив докторську дисертацію з теми «Дослідження над явищами витіснення одних металів іншими».
Працював у Харківському університеті, де вперше як самостійну наукову дисципліну читав курс фізичної хімії. Був членом Петербурзької академії наук. Праці М. Бекетова та його учнів заклали підвалини харківської фізико-хімічної школи.
Вам уже відома реакція між аргентум нітратом і хлоридпою кислотою. Під час цієї реакції випадає білий сирнистий осад (с. 164, рис 72 а).
Отже, зробимо висновок про взаємодію розчинів солей з кислотами. Реакції між солями й кислотами в розчинах відбуваються за умови, якщо:
1) утворюється нова сіль і нова кислота. Нова кислота є нестійкою та розкладається на відповідний їй оксид і воду. У результаті реакції виділяється газ;
2) випадає нерозчинний у кислотах осад.
3. Взаємодія солей із лугами (див. § 32).
Напишіть самостійно рівняння реакцій взаємодії цинк сульфату, плюмбум(ІІ) хлориду, ферум(ІІІ) нітрату з натрій гідроксидом.
За допомогою реакцій солей а лугами можна розпізнавати наявність у складі солі йонів металу. Наприклад, ви вже спостерігали взаємодію кунрум(ІІ) хлориду з натрій гідроксидом, наслідком якої є утворення синього осаду кунрум(ІІ) гідроксиду (due. лабораторний дослід 5, с. 170). Такий осад випадає, якщо до будь-якої розчинної солі Куируму долити розчин лугу:
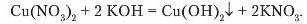
Отже, виявити в розчині наявність солей Куируму (йонів Ciii') можна за реакцією взаємодії з лугом.
За забарвленням і зовнішнім виглядом осадів у реакціях солей із лугами виявляють й інші йони металів у складі солей. Проведемо лабораторний дослід.
Лабораторний дослід 8
ВЗАЄМОДІЯ СОЛЕЙ З ЛУГАМИ У ВОДНОМУ РОЗЧИНІ
Завдання 1. Дослідіть взаємодію водних розчинів солей і лугів. Визначте, за яких умов ці реакції відбуваються до кінця.
Обладнання й реактиви: пробірки, хімічні склянки або пластина з заглибинами; білий і чорний екрани; таблиця розчинності кислот, основ, солей і амфотерних гідроксидів; розчини ферум(ЇІ) сульфату й ферум(ІІІ) хлориду, натрій сульфату, алюміній нітрату, натрій, калій, кальцій і барій гідроксидів.
Пригадайте визначення реакцій обміну. Назвіть умови, за яких вони відбуваються до кінця.
Хід роботи
Дослід 1. Налийте в дві склянки розчини ферум(ІІ) сульфату й ферум(ІП) хлориду об’ємом по 1-1,5 мл. Долийте в кожну а них кілька крапель розчину натрій гідроксиду.
Відбуваються реакції з випаданням осадів: ферум(ІІ) гідроксиду зеленуватого кольору (рис. 85 а) і ферум(ІІІ) гідроксиду бурого забарвлення (рис. 85 б).

Дослід 2. Налийте в пробірку розчин натрій сульфату об'ємом 1 1,5 мл. Долийте краплями розчин барій гідроксиду.
Na2SO4+ Ba(OH)2 = BaSO4I+ 2NaOH.
Утворюється білий осад барій сульфату. Якщо до останнього долити кислоти, то осад не розчиняється.
Дослід 3. Налийте в пробірку розчин натрій карбонату об’ємом 1-1,5 мл. Долийте розчин кальцій гідроксиду приблизно такого ж об’єму. Відбулася реакція:
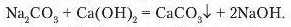
Знову ж таки випав білии осад, який за доливання кислоти розчиняється.
Результати лабораторних досліджень перекопали вас, що луги слугують добрим реактивом для якісного визначення йопів.
Завдання 2. Оформіть у зошиті результати досліджень. Зробіть відповідні висновки.
Рівняння якісних реакцій на катіони металів, що входять до складу солей, подано в таблиці 14.
Якісне визначення йонів металічних елементів
Таблиця 14
|
Йон |
Рівняння реакції |
Характерна ознака |
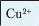 |
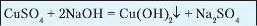 |
Синій осад |
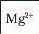 |
 |
Білий осад, розчиняється в кислотах |
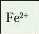 |
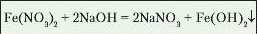 |
Зелену вато-біл и й осад, що буріє |
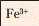 |
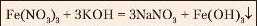 |
Бурий осад |
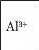 |
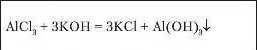 |
Білий драглистий осад, розчиняється в кислотах і лугах |
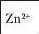 |
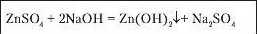 |
Білий осад, розчиняється в кислотах і лугах |
Знання ознак реакцій розчинів солей із лугами використовують для розв'язування експериментальних задач.
4. Взаємодія розчинів солей між собою.
Розчинні у воді солі вступають у реакції обміну.
Пригадайте, як розпізнати хпоридну та сульфатну кислоти.
Дослідимо експериментально, чи можна розпізнати солі цих кислот за допомогою тих самих реактивів.
Лабораторний дослід 9
РЕАКЦІЇ ОБМІНУ МІЖ СОЛЯМИ В РОЗЧИНІ
Завдання 1. Дослідіть взаємодію водних розчинів солей. Визначте тип реакцій та оформіть результати досліджень у зошиті. Зробіть відповідні ВИСНОВКИ.
Обладнання та реактиви: пробірки або пластина з заглибинами; чорний і білий екрани; розчини солей натрій хлориду, кальцій хлориду, аргентум(І) нітрату, натрій і калій сульфатів, барій хлориду, хлоридиої та сульфатної кислот.
Хід роботи
Дослід 1. Візьміть три пробірки. Налийте в першу з них хлориді «у кислоту, у другу — розчин натрій хлориду, у третю кальцій хлориду об’ємом по 1-1,5 мл. До кожної з пробірок долийте розчин аргептум(І) нітрату. Порівняйте результати взаємодії хлориді юї кислоти та її солей з розчином аргентум(І) нітрату.
Рівняння реакцій:
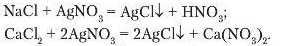
Як бачимо, у результаті обох реакцій відбулося утворення солей із випаданням осаду. Такий самий осад утворюється під час реакції хлоридиої кислоти з аргеитум(І) нітратом. Отже, аргеи-тум(І) нітрат є реактивом на хлоридну кислоту та її солі.
Дослід 2. Налийте в три пробірки по черзі розчини сульфатної кислоти, натрій і калій сульфатів об’ємом по 1 1,5 мл. До кожної з них долийте розчин барій хлориду. Рівняння реакцій:
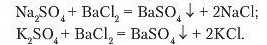
Порівняйте результати взаємодії сульфатної кислоти та її солей з розчином барій хлориду. Перевірте, чи розчиняються осади в нітратній кислоті, й зробіть висновок.
Отже, як засвідчили результати досліджень, барій хлорид є реактивом па сульфатну кислоту та її солі.
Зверніть увагу на те, що солі вступають у реакції обміну між собою тільки в розчинах.
Експериментальний метод у хімії. Розв’язування експериментальних задач. Під час вивчення властивостей речовин вам неодноразово доводилося виконувати лабораторні досліди чи спостерігати демонстраційні. Лабораторні досліди та практичні роботи проводять обов'язково за участю експериментальних задач.
Експериментальні задачі відрізняються від розрахункових тим, що їх розв'язування супроводжується проведенням дослідів (експериментів). Такий метод здобування знань називають експериментальним.
Які ж експериментальні задачі ви вивчили в темі «Основні класи неорганічних сполук»? Серед відомих типів експериментальних задач варто виокремити такі, що передбачають («знайомлеїіня й роз-
пізнавання хімічних речовин, добування речовин, здійснення ланцюжків перетворень, пояснення спостережуваних явищ (тибл. 15).
Таблиця 15
Типи експериментальних задач і їх приклади
|
Експериментальна задача |
Приклад експериментальної задачі |
|
Пояснення сіюстережунаних я вищ |
І Іоясніть, чому під час доливання оцту до харчової соди відбувається бурхливе виділення газу. |
|
Ознайомлення з хімічним и класти костям и конкретних речовин |
Охарактеризуйте загальні хімічні властивості хлоридної кислоти. |
|
Розпізнавання речовин за їх характерними класти костями |
Розпізнайте експериментально, у якій із пробірок міститься кислота, а в якій — луг. Розпізнайте за допомогою якісних реакцій натрій хлорид і калій сульфат. |
|
Доведення якісного складу речовин |
Доведіть експериментально, що видана речовина — магній сульфат. |
|
Добування речовин |
Запропонуйте два способи добування цинк хлориду. Напишіть рівняння реакцій. |
|
Здійснення ланцюжків перетворень |
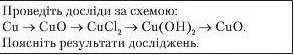 |
Використання експериментального методу вивчення речовин сприяє застосуванню теоретичних знань на практиці, формує вміння й павички правильного поводження з речовинами не тільки в хімічній лабораторії, а й у побутових, виробничих та інших умовах.
Лабораторний дослід 10
РОЗВ'ЯЗУВАННЯ ЕКСПЕРИМЕНТАЛЬНИХ ЗАДАЧ
Завдання 1. У двох пробірках під шифрами є хлоридна кислота й розчин натрій гідроксиду. Визначте експериментально, у якій із пробірок знаходиться кожна речовина.
З а вда пня 2. Добудьте цинк гідроксид і доведіть його амфотерний характер.
Завдання 3. Проведіть реакцію нейтралізації між нітратною кислотою та кальцій гідроксидом.
Завда її її я 4. Є розчини солей: натрій хлориду, натрій сульфату, кунрум(ІІ) сульфату. Визначте експериментально кожну я них.
Обладнання и реактиви:штатив із пробірками; розчини індикаторів; цинк хлорид, натрій хлорид, натрій сульфат, купрум(ІІ) сульфат, аргеитум(І) нітрат, барій гідроксид, натрій гідроксид, нітратна кислота.
Хід роботи
Розв’яжіть запропоновані експериментальні задачі. Опишіть спостереження та зробіть висновки.
Підсумовуючи результати лабораторних досліджень, можна зробити висновок: реактивом на хлориди є аргептум(І) нітрат (точніше, позитивно заряджений нон Аргеїггуму Ag*). У результаті реакцій випадає білий сирнистий осад ару.ентум(І) хлориду. Реактивом па сульфати є барій хлорид або інші розчинні сполуки Барію (точніше, позитивно заряджений йои Барію Ba2 ). У результаті випадає білий нерозчинний у кислотах осад барій сульфату.Інші якісні реакції па катіони металічних елементів подано в таблиці 14 (с. 194).
ПІДСУМОВУЄМО ВИВ HliUt
• Розчини солей взаємодіють з металами, якщо метал, що входить до складу солі, менш хімічно активний.
• Розчини солей реагують з кислотами. Реакції між солями й кислотами в розчинах відбуваються за таких умов:
1) виділяється газ:
2) випадає осад;
3) утворюється вода.
• Під час взаємодії розчинів солей з лугами утворюється нова сіль і нова основа.
• Розчини солей взаємодіють між собою. Реакції відбуваються до кінця, якщо один із продуктів реакції випадає в осад. Аргєнтум(І) нітрат є реактивом на хлоридну кислоту та її солі, а барій хлорид є реактивом на сульфатну кислоту та її солі.
• Розв’язування експериментальних задач базується на використанні якісних реакцій.
• Метод здобування знань за допомогою експерименту називають експериментальним. Його застосовують для розв’язування експериментальних задач.
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Перелічіть відомі вам фізичні властивості солей.
2. Визначте за таблицею розчинності кислот, основ, солей і амфотерних гідроксидів розчинні й нерозчинні солі з переліку речовин, що подані формулами: Са(МОз)г. MgCI2, CaCO3, CuSO4l AgCI1 AI2(SO4)3l BaSO4l AgBr, Na2S, Zn3(PO4)2.
3. Допишіть у правій частині формули продукти реакцій, поставте коефіцієнти й поясніть, які хімічні властивості солей вони характеризують: a) Fe + Pb(NO3)2 = Fe(NO3)2 + ... ; б) CaCI2 + AgNO3 = = Ca(NO3)2 + ... ; в) Fe(NO3)2 + KOH = Fe(OH)2 + ... ; г) Na2SO4 + + BaCl2 = NaCI +...; ґ) Hg(NO3)2 + K2S = HgS +...; д) Mg + Pb(NO3)2 = = Pb ... ; е) AICI3 + NaOH = NaCI + ....
4. На кальцій карбонат масою 5 г подіяли надлишком розчину нітратної кислоти. Обчисліть об'єм (н. у.) утвореного газу.
5. Магній карбонат масою 16,8 г нагріли до повного розкладу. Твердий залишок розчинили в надлишку сульфатної кислоти. Обчисліть масу утвореної солі. Назвіть сіль.
6. Запропонуйте спосіб розпізнавання розчинів натрій хлориду й натрій сульфату.
7. Запропонуйте три способи добування магній сульфату, користуючись знаннями про хімічні властивості речовин, і напишіть рівняння реакцій.
Це матеріал з підручника Хімія 8 клас Савчин
Автор: admin от 19-09-2016, 00:11, Переглядів: 3149