§ 29. Хімічні властивості кислот, їх взаємодія з основами та солями
Опанувавши матеріал параграфа, ви зможете:
• характеризувати взаємодію кислот з основами та солями;
• наводити приклади рівнянь реакцій, що підтверджують взаємодію кислот з основами та солями;
• шанувати експеримент, проводити його, описувати спостереження, робити висновки.
Зазначимо, що, окрім уже вивчених хімічних властивостей кислот, вони проявляють здатність вступати в хімічну взаємодію з основами та солями.
Хімічні властивості кислот.
Дослідимо ці властивості кислот за допомогою експериментів.
1. Взаємодія кислот з основами.
Пригадайте класифікацію основ.
У попередньому параграфі ви довідалися, що кислоти можна виявити за допомогою індикаторів. Якщо розчини реагентів і продуктів реакцій є прозорими, то їх перебіг практично не спостерігається. Тому реакції взаємодії кислот із лугами (розчинними у воді основами) проводять із використанням індикаторів. За зміною забарвлення індикатора судять про те, що реакція відбулася. Проведемо демонстраційні досліди.
Дослід 1. До пробірки, в яку налито 1 1,5 мл хлоридпої кислоти, додамо кілька крапель лакмусу (рис. 70).
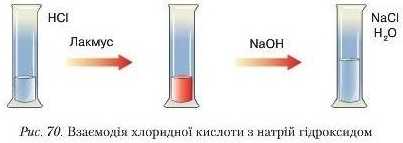
Що спостерігаєте? У хлоридиій кислоті розчин змінив забарвлення на червоний колір. До цієї ж пробірки доллємо такий самий об'єм розчину нагрій гідроксиду. Спостерігається знебарвлення лакмусу. Отже, між кислотою та лугом відбулася хімічна взаємодія. Запишемо рівняння реакції:
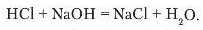
З рівняння видно, що серед продуктів реакції немає ні кислоти, ні лугу.
Аналогічно відбуваються реакції взаємодії будь-яких кислот з лугами, наприклад:
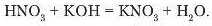
Продуктами розглянутих реакцій є солі натрій хлорид та калій нітрат і вода.
Визначте, до якого типу належать реакції взаємодії кислот з лугами. Сформулюйте визначення.
2. Взаємодія кислот із солями.
Кислотам властиво взаємодіяти з розчинами солей. Реакції між ними відбуваються за умови, якщо спостерігається:
а) випадання осаду;
б) виділення газу;
в) одним із продуктів реакції є вода.
Розглянемо приклади цих реакцій за допомогою демонстраційних дослідів.
Досл ід 2. У пробірку з розчином нітратної кислоти доллємо розчин натрій карбонату (або всиплемо суху сіль). Cпостері-
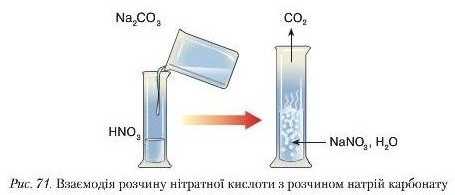
Унаслідок реакції обміну між нітратною кислотою та натрій карбонатом, утворюється нова сіль і нова кислота карбонатна H2CO3. Остання належить до нестійких кислот, тому відразу ж розкладається на Kapoon(IV) оксид (вуглекислий газ), виділення якого спостерігається, і воду.
гається бурхливе виділення бульбашок газу (рис. 71). Рівняння реакції:
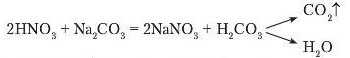
Інакше цю реакцію можна записати так:
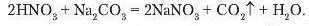
Деякі кислоти реагують з розчинами солей з утворенням характерних осадів, за наявністю яких виявляють кислотний залишок. З реакціями, що відбуваються з випаданням осаду, ознайомимося, провівши досліди з розпізнавання хлоридиої та сульфатної кислот. Знання таких реакцій дозволяє провести якісне визначення речовин.
3. Розпізнавання хлоридної та сульфатної кислот.
Досл ід 3. Надію двох колб наллємо по черзі розчини хлоридної та сульфатної кислот об’ємом по 1 2 мл. До колби з хло-ридною кислотою доллємо декілька крапел і» розчину аргептум(І) нітрату AgXO.. (рис. 72 а). До другої колби розчин барій хлориду BaClv (рис. 72 6). В обох колбах спостерігається випадання білого осаду.
Визначте, користуючись таблицею розчинності, які речовини випали в осад.
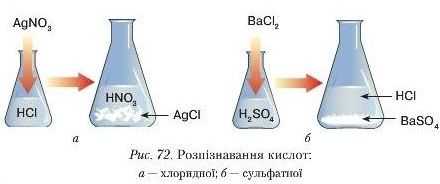
Уважно розглянувши обидва осади, бачимо, що вони різні. Осад аргеитум хлориду сирнистий (подібний до звурдженого молока) (рис. 72, а), а барій сульфату інтенсивно білий (рис. 72, б).
Якщо до обох пробірок з утвореними осадами обережно прилити розчину нітратної кислоти й перемішати їх вміст, то змін не спостерігається. Це означає, що осади нерозчинні в нітратній кил оті.
Напишіть самостійно рівняння обох реакцій. Укажіть, до якого типу вони належать.
Отже, за допомогою згаданих вище солей можна розпізнати хлорид ну та сульфатну кислоти. Зокрема, реактивомпа хлорид ну кислоту є аргеитум (І) нітрат,а па сульфатну барій хлорнії.
ПІДСУМОВУЄМО ВИВ tIEHE
• Кислоти взаємодіють з розчинними у воді основами (лугами), унаслідок чого утворюються сіль і вода. Реакція спостерігається за наявності індикатора.
• Кислоти реагують із розчинами солей з утворенням нової солі та нової кислоти.
• Реакції між кислотами та солями відбуваються, якщо: а) випадає осад; б) виділяється газ; в) одним із продуктів реакції є вода.
• Хлоридну та сульфатну кислоти можна розпізнати за певними реакціями: хлоридну — під час взаємодії з аргентум(І) нітратом (випадає білий сирнистий осад); сульфатну — з розчином барій хдориду (випадає інтенсивний білий осад). Обидва осади нерозчинні у кислотах.
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Охарактеризуйте взаємодію кислот із: а) основами; б) солями.
2. Наведіть приклади реакцій, що підтверджують взаємодію кислот із: а) основами; б) солями.
3. Допишіть праві частини рівнянь, поставте коефіцієнти й визначте, до якого типу належать ці реакції:
a) ZnO + HCI = ... + H2O; б) Ca(OH)2 + H2SO4 = CaSO4+ ...;
в) Na2O + HNO3 = ... + H2O; г) HNO3 + NaOH = ... + H2O;
ґ) H2SO4 + BaCI2 = HCI + ...; д) HCI + AgNO3 = AgCI + ....
4. Напишіть рівняння реакцій за поданими схемами:
а) H2O2 -> ? -> P2Ob -> H3PO4 -> K3PO4;
б) KCIO3 -> ? -> BaO -» Ba(OH)2 -> BaSO4.
5. Сульфатна кислота кількістю речовини 0,3 моль повністю прореагувала з натрій гідроксидом. Обчисліть масу й кількість речовини натрій гідроксиду, що вступив у реакцію.
5. Унаслідок реакції хлоридної кислоти з аргентум(І) нітратом утворився білий сирнистий осад масою 14,35 г. Обчисліть маси реагентів.
ЦІКАВО ЗНАТИ
Kapar Ієн — озеро на сході острова Ява, розташоване в кратері вулкана Ієн, є найбільшою природною кислотною водоймою (ширина 361 м і глибина 200 м). Воно заповнене концентрованою сульфатною кислотою. Подібні термальні кислотні озера трапляються в Аргентині.
Суміш нітратної та хлоридної кислот називають «царською горілкою». Таку назву ця суміш отримала завдяки тому, що вона єдина може розчинити «царя» всіх металів — золото.
Це матеріал з підручника Хімія 8 клас Савчин
Автор: admin от 19-09-2016, 00:06, Переглядів: 7630