§ 23. Класифікація неорганічних сполук, їх склад і номенклатура. Солі, основи
Опанувавши матеріал параграфа, ви зможете:
• формулювати визначення солей, основ;
• читати склад солей, основ;
• навивати середні солі, основи;
• пояснювати походження назв солей, основ;
• порівнювати склад середніх солей, основ (розчинних і нерозчинних), амфотерних гідроксидів;
• класифікувати основи й солі за складом.
Поміркуйте та скажіть з власного досвіду, де в побутових умовах ви маєте справу з солями.
Солі, їх склад, назви. Солі розглядають як похідні кислот. Під час хімічних реакцій у кислотах атоми Гідрогену частково або повністю заміщуються попами (катіонами) металічних елементів. Тому до складу солей входять катіони металічних елементів й аніони кислотних залишків.
Розгляньте подану нижче схему (рис. 47). Користуючись нею додайте пропущену видову назву та самостійно сформулюйте визначення поняття «солі». Звірте з визначенням, поданим у § 22.
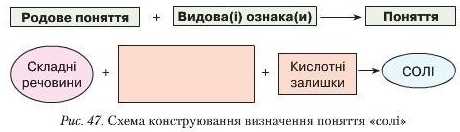
Солі, утворені внаслідок заміщення всіх атомів Гідрогену в кислоті па йоли металічних елементів (катіони), називають середніми. Наприклад, калій хлорид KCl, натрій карбонат NaliCO3, калій силікат KliSiO3.
Проаналізуйте склад і назви поданих вище двох солей і поясніть, від чого походять назви середніх солей.
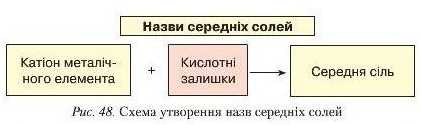
Очевидно, іцо назви середніх солей походять від назви катіона металічного елемента й назви кислотного затишку (рис. 48). Назви кислотних залишків легко запам'ятати, якщо ви добре знаєте назви кислот (табл. 9). Сіль, до складу якої входить катіон Нагрію й аніон хлору, називають натрій хлоридом. Якщо до
складу солі входять два катіони Калію та су.пьфат-аніоп кислотний залишок сульфатної кислоти, — це копій сульфат.
Залежно від того, катіон якого металічного елемента заміщує атоми Гідрогену, одна й та сама кислота може утворювати багато солей. Наприклад, хлоридпа кислота утворює, окрім згаданого натрій хлориду, ще калій хлорид, кальцій хлорид, магній хлорид тощо. Тобто всі солі цієї кислоти мають загальну назву хлориди. Аналогічно це стосується будь-якої іншої кислоти.
Загальні назви солей неорганічних кислоті приклади їх формул подано в таблиці 11.
Таблиця 11
Назви й формули неорганічних кислот і солей
|
Назви кислот |
Формули кислот |
Загальні назви солей |
Приклади формул середніх солей |
|
хлориди а |
неї |
хлориди |
KCI, ZnCI2, AICI1 |
|
фторидна |
HF |
фториди |
XaF, CaF2, CrF1 |
|
йодидна |
Hl |
йодиди |
KI1MgI21ZnI2 |
|
сульфідна |
H2S |
сул ьфіди |
PbS, Na2S, ZnS |
|
Сул ьфатна |
H1SO, |
сульфати |
Na2SO4, CaSO4 |
|
сульфітна |
H2SO, |
сульфіти |
K2SO3, CaSO3 |
|
карбонатна |
H1CO1 |
карбонати |
MgCO1, FeCO3 |
|
силікатна |
H2SiOa |
силікати |
Na2SiO1, K2SiO3 |
|
нітратна |
HNO1 |
нітрати |
Zn(NO3)2, NaNO3 |
|
ортофосфатна |
H1PO. |
ортофоефати |
AIFO4, Ba3(PO4)2 |
 |
|||
Якщо метал проявляє змінну валентність, то він може сполучатися з різною кількістю кислотних залишків однієї й тієї ж кислоти. Наприклад: Cr(NO3)2 хром(ІІ) нітрат; Cr(NO3)3 хром(ІІІ) нітрат. У назвах таких солей обов’язково вказують валентність елемента римською цифрою, узявши її в дужки.
Складання формул солей за валентністю. У попередньому параграфі згадувалося про те, що валентність кислотного залишку легко визначити за кількістю атомів Гідрогену в молекулі кислоти. Це важливо під час складання формул солей.
Пригадайте, як складають формули бінарних сполук.
Під час складання формул бінарних сполук варто пам'ятати, що сума валентностей атомів металічних елементів мас дорівнювати сумі одиниць валентності кислотних залишків.
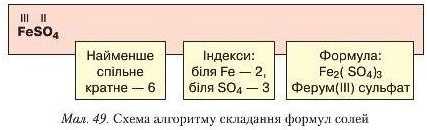
Наприклад, треба скласти формулу ферум(ІІІ) сульфату. Щоб виконати це завдання, пропонуємо скористатися алгоритмом складання формули та його схемою (рис. 49).
1. Запишіть формули металічного елемента й кислотного залишку.
2. Проставте римськими цифрами валентність металічного елемента й кислотного залишку.
3. Знайдіть найменше спільне кратне для чисел, що відповідають валентностям металічного елемента й кислотного залишку.
4. Поділіть найменше спільне кратне почергово на валентність металічного елемента й кислотного залишку, визначте індекси й проставте їх унизу біля відповідних атомів чи груп атомів. Якщо до складу солі входить кілька кислотних залишків, їх беруть у круглі дужки, а внизу проставляють індекс.
Основи, їх склад і назви, класифікація. Основи розглядають як сполуки оксидів із водою. Тому їх загальна назва гідрати оксидів, або гідроксиди.
Пригадайте з курсу хімії 7 класу, що ви знаєте про взаємодію оксидів металічних і неметалічних елементів із водою.
Оксиди найактивніших металічних елементів легко сполучаються з водою. Результатом таких реакцій є гідроксиди. Якщо до складу гідроксиду входять 1-3 гідроксильних груп, то вони утворюють новий клас неорганічних сполук — основи.
Наведемо приклади реакцій утворення основ:
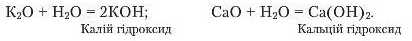
З формул KOH і Ca(OH)., видно, що до складу основ входять катіони металічних елементів і гідроксильні групи ОН. Отже, можемо скласти схему утворення назв основ (рис. 50).
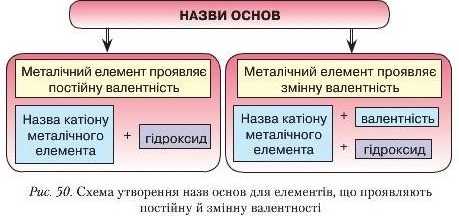
Основи класифікують за двома ознаками:
1) розчинність у воді;
2) число гідроксильних груп (рис. 51).
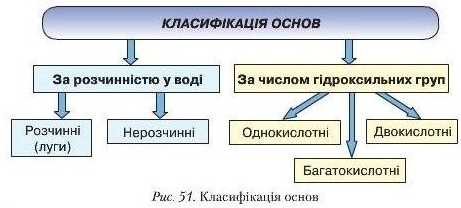
Наведіть приклади основ за поданою класифікацією (рис. 51). Загальна формула основ:
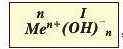
де п валентність катіона металічного елемента і число гідро-ксид-йопів; MtP+ катіон металічного елемента; 0Н~ — гідроксид-йои.
Число гідроксильних груп належить від валентності металу.
Розчинні у воді основи називають лугами. За таблицею розчинності можна визначити розчинні й нерозчинні у воді основи.
ПІДСУМОВУЄМО ВИВ НЕПЕ
• Солі— складні речовини, утворені катіонами металічних елементів і аніонами кислотних залишків.
• Солі, утворені внаслідок заміщення всіх атомів Гідрогену в кислоті на атоми металічних елементів (катіони), називають середніми.
• Назви солейпоходять від назви катіона з додаванням назви аніона. Якщо метал проявляє змінну валентність, її проставляють після назви катіона римськими цифрами в круглих дужках.
• Основи— складні речовини, до складу яких входять катіони металічних елементів й один або кілька аніонів гідроксильних груп.
• Назви основпоходять від назви катіона з додаванням слова «гідроксид». Якщо металічний елемент проявляє змінну валентність, як і в солях, її проставляють римськими цифрами в круглих дужках.
• Основикласифікують за: а) розчинністю у воді (розчинні — луги та нерозчинні); б) числом гідроксильних груп (одно-, дво-, бага-токислотні).
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Сформулюйте визначення: а) солей; б) основ. Поясніть їх склад.
2. Наведіть приклади: а) середніх солей; б) основ.
3. Назвіть за хімічними формулами:
а) солі: CaCO3, MgSiO3l Na2S, FeSO4, AI(NO3)3, КСІ, Znl2;
б) основи: NaOH, Ba(OH)2, Fe(OH)2, LiOH1 Ca(OH)2.
4. Складіть формули солей за їх назвами: кальцій карбонат, алюміній сульфат, магній ортофосфат, калій сульфід, натрій силікат.
5. Назвіть ознаки, за якими класифікують основи, і наведіть приклади: а) розчинних і нерозчинних у воді: б) однокислотних, дво-кислотних основ, користуючись таблицею розчинності.
6. Класифікуйте речовини на чотири класи за Ix формулами: Zn(OH)2, AI2O3, HF, NaCI1 K2SO4, H2S1 AICl3, Fe(OH)2, NaOH, ZnO, HNO3, MnO2. Назвіть їх.
* ЦІКАВО ЗНАТИ
Елементи, що проявляють змінну валентність, можуть утворювати оснбвні, кислотні й амфотерні оксиди (табп. 12).
Таблиця 12
Класифікація оксидів Хрому
|
Формули оксидів |
Валентність елемента в оксиді |
Назви оксидів |
Характер оксидів |
|
CrO |
11 |
хром(ІІ) оксид |
основний |
|
Cr2O3 |
111 |
хро.м(Ш) оксид |
амфотерний |
|
CrO3 |
Vl |
XpoM(Vl) оксид |
кислотний |
Як ви здогадуєтеся, оксид, у якому елемент проявляє найнижчу валентність, є оснбвним, найвищу — кислотним, а оксид, у якому валентність проміжна, проявляє амфотерний характер.
В організмі людини сіль накопичується переважно в шкірі. Якщо харчування позбавлене солі, то її втрати в крові досить великі. У такому випадку шкіра передає запаси солі в кров для підтримання її сталої концентрації. Це фізіологічне явище досить часто діє позитивно під час шкірних та інших захворювань. Тому лікарі призначають безсольові дієти, особливо тоді, коли наявні захворювання нирок.
Це матеріал з підручника Хімія 8 клас Савчин
Автор: admin от 19-09-2016, 00:02, Переглядів: 2770