§ 6. Структура періодичної системи хімічних елементів
Опанувавши матеріал параграфа, ви зможете:
• знати, чому саме таке графі чиє зображення мак таблиця періодичної зміни хімічних елементів.
• розрізняти великі й малі періоди, головні (А) й побічні (Б) підгрупи;
• пояснювати періодичність зміни властивостей хімічних елементів;
• використовувати інформацію, закладену в періодичній системі, для класифікації елементів (металічний або пеметалічиий) та визначення їх валентності, класифікації простих речовин (метал або неметал), визначення хімічного характеру оксидів (кислотний, амфотерний, основний), гідратів оксидів (кислота, амфотерний гідроксид, основа), сполук елементів з Гідрогеном.
Структура періодичної системи хімічних елементів. Періодичний закон знайшов своє відображення в численних варіантах періодичної системи {див. короткий і довгий варіанти на форзацах). Щоб краще зрозуміти, чому таблицю назвали періодичною системою, з’ясуємо, що ж таке система. Поняття «система» означає цілісність, що складена з частин, проте ці частини взаємопов’язані певними залежностями. Тому основне наше завдання знайти ті залежності між елементами та їх сполуками, які уможливлять твердження, що відомості про них є дійсно системними.
Розташовані в ряд хімічні елементи в порядку зростання відносних атомних мас Дмитро Менделєєв пронумерував і, як уже відомо, назвав порядковим номером. Після цього вій поділив JiTBopeiinft ряд иа коротші ряди, у яких спостерігалася зміна властивостей від типових металічних (лужних) до типових пеметалічпих (галогенів) елементів. Ці ряди було названо періодами. Після відкриття благородних газів їх розташували за галогеном, тому в сучасній періодичній системі вони завершують кожний період.
Періоди це горизонтальні ряди елементів, розташовані в порядку зростання їх атомних мас, що починаються лужним металічним і закінчуються інертним елементом.
Періоди вміщують 2, 8, 18 або 32 елементи. Залежно від кількості елементів їх поділяють на малі та великі (див. форзаци). Періодична система вміщує 7 періодів, що утворюють десять рядів. Сьомий період незавершений, він містить 26 елементів.
Періоди, у яких елементи розташовані в один ряд, називають малими. Великі періоди складаються з двох рядів (рис. в).
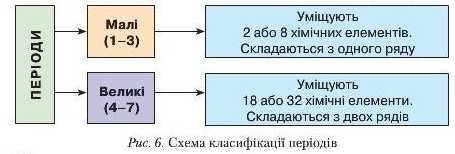
Назвіть, користуючись періодичною системою, малі та великі періоди.
Розташовані один під одним періоди утворюють таблицю, у якім чітко вирізняються вертикальні стовпці групи. Аналізуючи дані таблиці2, ви переконалися, що в групи потрапляють елементи, подібні за властивостями.
Групи вертикальні стовпці хімічних елементів, подібних за властивостями.
Назвіть самостійно три відомі вам природні родини елементів.
У періодичній системі (короткий варіант) е вісім груп. Усі вони пронумеровані римськими цифрами від T до VIII. Кожна з груп поділяється па дві підгрупи: головну (А) і побічну (Б). Схематично це можна подати так (рис. 7).
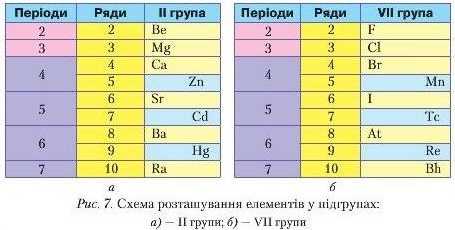
In поданої вище схеми видно, що елементи II групи (рис. 7 а) поділені на дві підгрупи. До складу головної підгрупи входять елементи малих (1 і 3) та великих (4 7) періодів. Сюди можуть входити й металічні та неметалічні елементи. Вони розташовані ліворуч. До побічної підгрупи входять елементи лише великих періодів: Цинк, Кадмій, Меркурій, і тільки металічні.
Назвіть самостійно, користуючись періодичною системою, елементи головної та побічної підгруп Vll групи.
Особливу будову має VIII група (рис. 8). Її побічна підгрупа включає три тріади металічних елементів, що отримали назву родина Феруму, а всі інші — платинових елементів. Головна підгрупа — це інертні елементи, якими завершується кожний період.
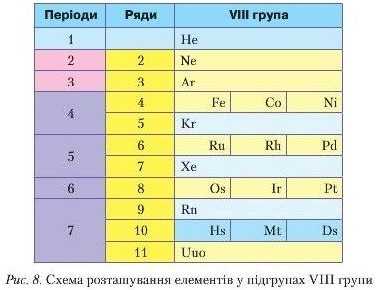
Сформулюйте самостійно визначення головних і побічних підгруп.
ІНШІ СТРУКТУРНІ ЧАСТИНИ ПЕРІОДИЧНОЇ СИСТЕМИ. У періодичній системі під 7 періодом розташовані 2 ряди загальних формул: вищі оксиди й леткі сполуки елементів з Гідрогеном. Це означає, що елементи, які входять до цієї групи, проявляють вищу валентність, що відповідає номеру групи. Таким чином, за номером групи легко визначити нищу валентність елемента.
Леткі сполуки елементів з Гідрогеном утворюють немета-лічііі елементи. У періодах вони розташовані в IV-VH групах. За загальними формулами цих сполук визначають валентність елемента за Гідрогеном.
І, щоб у вас пе виникли сумніви щодо неповної структури періодичної системи, необхідно зазначити, що вона завершується ще двома рядами елементів під назвами «Лантаноїди» та «Актиноїди». Вони об’єднані в родини, названі за подібністю до Лантану (А? 57) та Актинію (№ 89), і проявляють подібні до них властивості. Через те, що в одну клітинку періодичної системи вони не поміщаються. їх винесено окремими рядками.
Отже, розташування елементів за групами полегшує їх вивчення. Знаючи будову та властивості одного, можна передбачувати будову та властивості всіх інших, що входять до складу групи чи підгрупи.
Пригадайте, у чому проявляється подібність властивостей природних груп металічних і неметалічних елементів та їх сполук.
Треба згадати й про довгий варіант періодичної системи. На відміну від короткого, періодом є кожний горизонтальний ряд елементів. Він також уміщує 18 груп, поділ на підгрупи тут відсутній (див. форзац 2).
Закономірності періодів і груп. У періодах спостерігаються певні закономірності. У малих періодах, зліва направо, зі зростанням відносних атомних мас елементів відбувається послаблення їх металічних і посилення неметалічних властивостей. Аналогічні зміни відбуваються з властивостями оксидів і гідроксидів, утворених цими елементами. Основні властивості послаблюються, а кислотні посилюються. Наприклад, проаналізуємо III період (гпабл. 3).
У головних підгрупах спостерігаються певні зміни у властивостях елементів. Зі зрос танням відносних атомних мас зверху вниз посилюються металічні властивості й послаблюються неме-талічні. Тому хімічна активність для металів посилюється, а для неметалів послаблюється. У зв'язку з цим в оксидах і гідратах оксидів, утворених металічними елементами, посилюються ото ані властивості. Для оксидів і гідратів оксидів неметалічних елементів спостерігається послаблення їх кислотного характеру.
Зміна характеру властивостей елементів та їх сполук V ИІ періоді
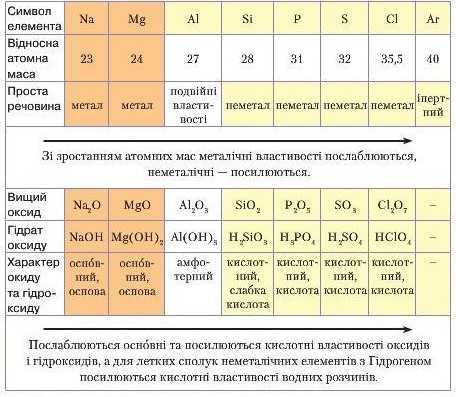
лк уже відомо, на номером групи можна визначити вищу валентність елемента в сполуках. Однак треба пам'ятати про те, що існують винятки для елементів деяких підгруп. Такими винятками є елемент І групи побічної підгрупи Кунрум та елемент головної підгрупи VTI групи Флуор.
Окрім цього, ураховуючи хімічні властивості елементів і їх сполук, Д. І. Менделєєв зробив деякі правки, що суперечили загальній закономірності. Тому Аргон Ar учений розташував перед Калієм К, Телур Те перед Толом І, Кобальт Co перед Нікелем Ni.
Знайдіть у періодичній системі значення відносних атомних мас цих елементів і поясніть, які саме порушення ви спостерігаєте.
ПІДСУМОВУЄМО ВИВ НЕПЕ
• Періодичний закон, відкритий Д. І. Менделєєвим, знайшов своє графічне відображення в таблиці, яка дістала назву “Періодична система хімічних елементів».
• Періодична система має чітку структуру, де кожний елемент отримав своє місце й відповідну характеристику. Складовими періодичної системи є періоди та групи.
• Періоди — це горизонтальні ряди елементів, розташовані в порядку зростання їх атомних мас, що починаються лужним металічним і закінчуються інертним елементом. Періоди, залежно від кількості елементів, поділяють на малі (2 або 8 елементів) і великі (18 або 32 елементи).
• Групи — це вертикальні стовпці хімічних елементів, подібних за властивостями. Групи поділяються на головні (А) і побічні (Б). До головних віднесено ті підгрупи, які вміщують елементи малих і великих періодів. У побічні підгрупи входять елементи тільки великих періодів.
• У періодах зі зростанням відносних атомних мас елементів послаблюються металічні властивості й посилюються немета-лічні. Для оксидів і гідратів оксидів відбувається послаблення оснбвних і посилення кислотних властивостей. Посилюється кислотний характер розчинів летких сполук неметалічних елементів із Гідрогеном.
• У групах зі зростанням відносних атомних мас елементів посилюються металічні властивості й послаблюються неметалічні. Для оксидів і гідратів оксидів відбувається послаблення кислотних властивостей.
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Сформулюйте визначення: а) періоду; б) групи.
2. Назвіть, користуючись періодичною системою, елементи 1-3 періодів.
3. Поясніть, які зміни спостерігаються в періоді від лужних металічних до інертних елементів.
4. Поясніть, які ознаки покладено в основу класифікації елементів Д. І. Менделєєвим і чому.
5. Обґрунтуйте, чому відкритий Д. І. Менделєєвим закон дістав назву періодичного закону, а таблиця, що є графічним його відображенням, названа періодичною системою.
6. Поясніть, як зі зростанням відносних атомних мас елементів змінюються властивості елементів, їх оксидів і гідратів оксидів у: аї пепіолах: бї rnvnax
7. Доведіть на прикладі: а) лужних металічних елементів; б) галогенів, що в групах об’єднані елементи, подібні за властивостями.
Це матеріал з підручника Хімія 8 клас Савчин
Автор: admin от 18-09-2016, 23:45, Переглядів: 4618