§ 31. Расчеты по уравнениям химических реакций
Вспомните: способы вычисления количества вещества по известной массе или
объему (§ 24-26).
Когда повар готовит блюдо, он смешивает продукты в определенных соотношениях. Так и химик перед проведением химической реакции должен решить, в каком массовом соотношении следует смешать реагенты, и вычислить массу продукта, который должен образоваться.
Такие расчеты можно провести по уравнениям химических реакций. Если известна масса одного из веществ, участвующих в реакции, то можно определить массы всех других веществ — и реагентов, и продуктов реакции.
Химическое уравнение показывает, какие вещества и в каком соотношении взаимодействуют, а также в каком соотношении образуются продукты реакции. Например, уравнение реакции взаимодействия водорода с азотом
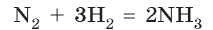
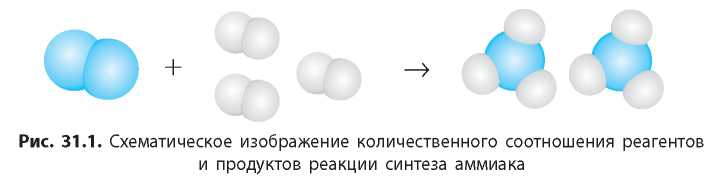
показывает, что три молекулы водорода H2 взаимодействуют с одной молекулой азота N2 с образованием двух молекул аммиака NH3 (рис. 31.1).
Такое же соотношение будет и для количества вещества всех соединений в реакции: три моля водорода вступает в реакцию с одним молем азота, и при этом образуется два моля аммиака.
Если для проведения реакции взять не три моля водорода, а любое другое количество (например, 3х моль), то количество прореагировавшего азота будет в три раза меньше, чем количество водорода, т. е. n(N„) = x моль:
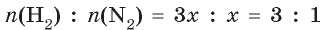
Таким образом, вещества вступают в химические реакции в количествах, пропорциональных их коэффициентам в уравнении реакции (стехиометрическим коэффициентам). Другими словами, соотношение количеств реагентов (в молях) равно соотношению соответствующих коэффициентов в уравнении реакции.
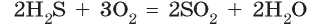
Мы видим, что два моля сероводорода реагирует с тремя молями кислорода с образованием двух молей сернистого газа и двух молей воды. Если в реакцию вступает x моль сероводорода, то соотношение реагентов и продуктов реакции выглядит так:
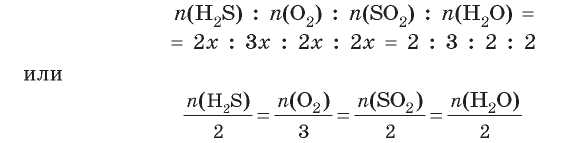
Таким образом, для любой химической реакции, которую можно описать уравнением:
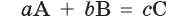
справедливо соотношение для количества вещества всех участников реакции:
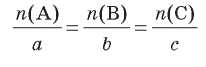
По этому соотношению можно проводить любые расчеты по уравнению химической реакции.
Задача 1. Какое количество вещества кислорода необходимо для сжигания сероводорода количеством 1,5 моль?

При проведении реакций необходимо знать не только количества веществ, но и их массы или объемы. Эти величины связаны соотношениями:

Но задачи по уравнениям химических реакций проще решать с использованием количества вещества. Если в условии задачи даны масса или объем вещества, то удобнее сразу вычислить количество вещества и далее использовать эту величину для расчетов.
Задача 2. Вычислите объем азота (н. у.), необходимый для получения аммиака NH3 количеством 0,8 моль.

Задача 3. Вычислите массу фосфор^) оксида, который можно получить сжиганием фосфора в кислороде объемом 11,2 л (н. у.).

Задача 4. Простое вещество массой 10,8 г сожгли, на что израсходовали кислород объемом 6,72 л (н. у.). В результате образовался оксид состава Е2О3. Какое вещество сожгли?

Выводы
Химические вещества вступают в химические реакции в четко определенных соотношениях. Количества веществ всех участников реакции соотносятся как их стехиометрические коэффициенты в уравнении реакции. Для реакции aA + bB = cC справедливо соотношение:
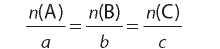
Задания для усвоения материала
1. Проанализируйте уравнение реакции горения метана аналогично тому, как это сделано в данном параграфе для реакции горения сероводорода.
2. В каком количественном соотношении следует смешать железо с серой для получения феррум(ІІ) сульфида?
3. Определите соотношение количества вещества реагентов для получения купрум(ІІ) оксида из простых веществ.
4. Вычислите количество вещества фосфор^) оксида, который образуется при сгорании фосфора количеством вещества 2 моль. Какое количество вещества кислорода тратится при этом?
5. Определите количество вещества кальций гидроксида, который образуется при взаимодействии воды: а) с 0,5 моль кальций оксида; б) 8 г кальций оксида.
6. Составьте уравнение реакции сгорания аммиака NH3 в кислороде с образованием азота и воды. Вычислите объем кислорода (н. у.), который необходим для сжигания аммиака количеством 24 моль. Какой объем (н. у.) каждого из продуктов реакции при этом образуется?
7. Вычислите массу кальций карбоната, который образуется при взаимодействии карбон(^) оксида объемом 11,2 л (н. у.) с кальций оксидом.
8. Вычислите массу сульфур^І) оксида, необходимую для получения сульфатной кислоты массой 4,9 г.
9. Вычислите массу гидроген пероксида, необходимую для получения кислорода объемом 5,6 л (н. у.).
10. Карбон(^) оксид можно получить сжиганием углерода или метана. Вычислите, какого вещества и во сколько раз больше (по массе) необходимо для получения карбон(^) оксида объемом 28 л (н. у.).
11. Вычислите массу ортофосфатной кислоты, которая образуется при взаимодействии фосфор^) оксида массой 1 кг с водой.
12. При пропускании сульфур(^) оксида через раствор барий гидроксида образовалась соль массой 43,4 г. Вычислите объем (н. у.) израсходованного газа.
Это материал учебника Химия 8 класс Григорович
Автор: admin от 16-09-2016, 23:43, Переглядів: 2512