§ 18. Ковалентная связь
Вспомните: определение электронной конфигурации атома (§ 13).
Образование ковалентной связи
Вы уже знаете, что при образовании химической связи атомы стремятся к тому, чтобы на их внешнем энергетическом уровне было два или восемь (октет) электронов. Этого можно достичь несколькими способами. Один из них заключается в объединении неспаренных электронов в общие электронные пары, которые принадлежат одновременно обоим атомам. Такую связь называют ковалентной.
Химическую связь, которая возникает в результате образования общих электронных пар, называют ковалентной.
Рассмотрим образование ковалентных связей в некоторых простых молекулах. В самом простом из известных атомов — атоме Гидрогена — на внешнем электронном уровне находится один электрон:
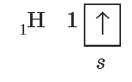
При изображении образования химической связи валентные электроны принято обозначать точкой или крестиком:
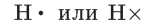
Такие формулы называют электронными формулами, или электронно-точечными формулами, или формулами Льюиса. Образование молекулы водорода Н2 можно записать в виде формулы:
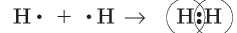
Таким образом, каждый атом Гидрогена отдает свой валентный электрон в «общее пользование». При этом образуется общая электронная пара, которая одновременно принадлежит обоим атомам Гидрогена. Каждый атом Гидрогена при этом приобретает электронную конфигурацию инертного элемента (Гелия), т. е. получает заполненный внешний электронный слой, который обусловливает устойчивость молекулы водорода.
Общую электронную пару, которая определяет химическую связь, можно обозначить черточкой. Таким образом составляют структурные формулы, например, для водорода:
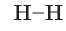
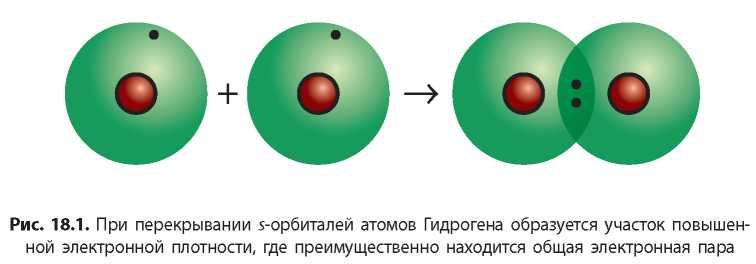
Между атомами Гидрогена образуется одна общая электронная пара, т. е. одна химическая связь. Такую связь называют ординарной, или одинарной. Если изобразить образование общей электронной пары перекрыванием соответствующих орбиталей, то получится молекула, модель которой изображена на рисунке 18.1: две s-орбитали атомов Гидрогена перекрываются, и в области перекрывания образуется повышенная электронная плотность.
Атомы неметаллических элементов второго периода стремятся дополнить свою электронную оболочку до октета. Составим схему образования связи в молекуле фтора F2. Атом Флуора содержит на
внешнем уровне семь электронов — три электронные пары и один неспаренный электрон:
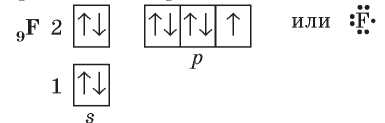
До завершения внешнего уровня атому Флуора не хватает одного электрона, поэтому каждый из атомов предоставляет в общее пользование по одному неспаренному электрону:

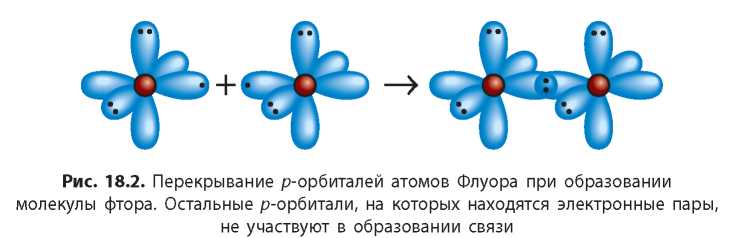
В молекуле фтора F2 атомы Флуора образуют одну общую электронную пару путем перекрывания ^-орбиталей (рис. 18.2). Таким образом, у каждого из атомов на внешнем уровне становится по восемь электронов (октет), из которых два являются общими, а шесть (три пары) не участвуют в образовании химической связи и принадлежат самому атому. Эти три электронные пары называют неподеленными.
Образование двойной и тройной связей
При взаимодействии двух атомов, у каждого из которых есть несколько неспаренных электронов, образуется одновременно несколько общих электронных пар. Примером является молекула кислорода O2. В атоме Оксигена на внешнем уровне шесть электронов: две электронные пары и два неспаренных электрона.
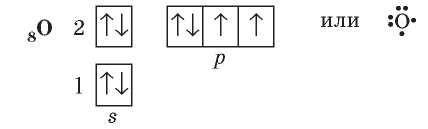
Благодаря этому каждый атом Оксигена получает завершенный внешний энергетический уровень из восьми электронов (октет). Такую химическую связь называют двойной и обозначают двумя черточками.
В атомах Нитрогена на внешнем электронном уровне находятся три неспаренных электрона:

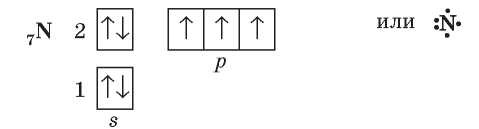
Благодаря им при образовании молекулы азота N2 появляются три общие электронные пары:
Эти неспаренные электроны принимают участие в образовании двух общих электронных пар:
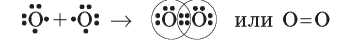
Каждый из атомов Нитрогена завершает внешний электронный уровень, который содержит октет электронов: шесть электронов, общих для обоих атомов (три общие пары), и у каждого из атомов — по одной собственной электронной паре. Связь в молекуле азота называют тройной и обозначают тремя черточками.
Образование связи между разными атомами
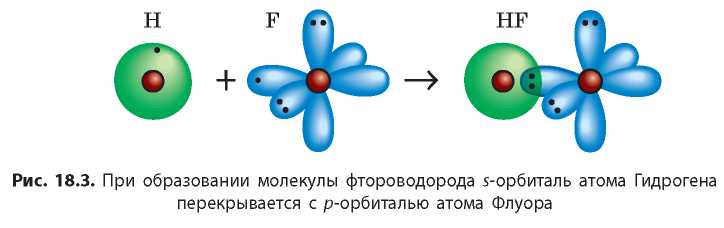
Мы рассмотрели, как образуется химическая связь в молекулах простых веществ, но ковалентная связь может образоваться и между атомами разных элементов. В молекуле гидроген флуорида HF (фтороводорода) атомы за счет «чужого» электрона завершают свой внешний энергетический уровень: атом Гидрогена — первый, а атом Флуора — второй (рис. 18.3).

Если в одном атоме есть несколько неспаренных электронов, то он может образовать ковалентные связи одновременно с несколькими атомами. В молекуле воды H2O атом Оксигена образует две ординарные ковалентные связи с двумя атомами Гидрогена:
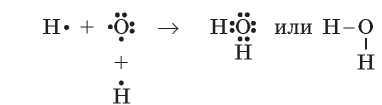
Каждый атом Гидрогена в молекуле воды содержит на внешнем уровне по два электрона (общих с атомом Оксигена), а атом Оксигена — восемь электронов (четыре свои и две общие пары).
Между атомами разных элементов может также образовываться и двойная связь, например в молекуле углекислого газа CO2 между атомами Карбона и Оксигена:

В этом случае каждый из атомов Оксигена образует одну двойную связь, а атом Карбона — две двойные связи.
Обратите внимание, что в обычном состоянии в атоме Карбона на внешнем уровне находятся только два неспаренных электрона. Для того чтобы образовать четыре химические связи, атом Карбона поглощает небольшое количество энергии и переходит в так называемое возбужденное состояние (графически его обозначают звездочкой). Поглощая дополнительную энергию, один электрон с s-орбитали переходит на свободную р-орбиталь, и на внешнем уровне атома Карбона теперь четыре неспаренных электрона:
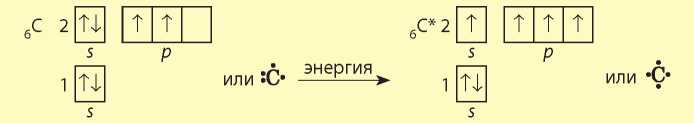
Такой процесс довольно распространен и происходит в тех случаях, когда на внешнем уровне атомов есть свободные орбитали и электронные пары. Благодаря ему в атомах некоторых элементов при поглощении дополнительной энергии в возбужденном состоянии становится больше неспаренных электронов, чем в обычном (основном) состоянии, и атомы элементов могут проявлять свою высшую валентность.
Лингвистическая задача
На латыни со означает «общий», а vales — «имеющий силу». Основываясь на этом, объясните значение термина «ковалентный».
На латыни ordinary имеет значение «обычный». Как вы считаете, почему термины «одинарная связь» и «ординарная связь» являются синонимами?
Выводы
1. Ковалентная связь возникает благодаря объединению электронов. При этом между атомами образуются общие электронные пары, которые принадлежат обоим соединенным атомам. При образовании ковалентной связи за счет неподеленных электронных пар и общих электронов атом приобретает электронную конфигурацию атома инертного элемента.
2. Связь, которая возникает благодаря образованию одной общей электронной пары, является ординарной. Атомы, у которых на внешних электронных уровнях больше одного неспаренного электрона, могут образовывать двойную связь (две общие электронные пары) и тройную связь (три общие электронные пары).
Контрольные вопросы
1. Дайте определение ковалентной связи.
2. Общая электронная пара — это: а) пара электронов, принадлежащая обоим атомам, между которыми образована химическая связь; б) пара электронов, которая не образует химической связи; в) два электрона, которые находятся на одном энергетическом подуровне.
3 Какие электроны называют неспаренными?
4. Какую электронную пару называют неподеленной?
5. Какую связь называют: а) ординарной; б) двойной; в) тройной? Приведите примеры молекул с такими связями.
Задания для усвоения материала
1. Сколько электронных пар и неспаренных электронов содержат на внешнем энергетическом уровне атомы: а) Хлора; б) Сульфура; в) Фосфора? Составьте для них формулы Льюиса.
2. Сколько неспаренных электронов содержит: а) атом Флуора; б) молекула фтора?
3. Почему не могут существовать двухатомные молекулы инертных элементов?
4. Благодаря электронам какого уровня осуществляется связь между атомами: а) в молекуле водорода; б) молекуле хлора?
5. Составьте формулы Льюиса для молекул хлороводорода HG, сероводорода H2S, аммиака NH3, метана CH4. Сколько общих и неподеленных электронных пар содержат атомы в каждом случае?
6. Составьте формулу Льюиса для молекулы серы S2. Сколько электронных пар принимают участие в образовании ковалентной связи между атомами Сульфура? Соблюдается ли правило октета?
8*. Составьте графические электронные формулы строения электронной оболочки атома Сульфура в основном и возбужденном состояниях, чтобы на внешнем электронном уровне атома было четыре и шесть неспаренных электронов. Составьте формулы Льюиса для сульфур(^) оксида и сульфур^О оксида.
9*. Составьте графические электронные формулы для электронных оболочек атомов Фосфора и Хлора в основном и в разных возможных возбужденных состояниях. Основываясь на них, объясните возможные валентности, которые могут проявлять атомы Фосфора и Хлора в соединениях.
10*. Образование ковалентной связи может происходить по обменному (рекомбинационному) механизму, который описан в этом параграфе, и по донорно-акцепторному. Найдите в дополнительной литературе отличительные и общие черты этих двух механизмов. Приведите примеры частиц, образование которых происходит по донорно-акцепторному механизму образования ковалентной связи.
Это материал учебника Химия 8 класс Григорович
Автор: admin от 16-09-2016, 23:34, Переглядів: 3072