§ 13. Распределение электронов в электронной оболочке атомов
Вспомните:
• как определить состав атомов (§ 9);
• структуру электронной оболочки атома (§ 12).
Вместимость орбиталей
Электроны распределяются по орбиталям согласно определенным правилам. Первым рассмотрим правило, определяющее число электронов, которое может содержать одна орбиталь: на каждой орбитали максимально могут разместиться два электрона, которые имеют одинаковую энергию, но отличаются особым свойством — спином.
Спин электрона — это его внутреннее свойство, характеризующее отношение электрона к магнитному полю. Наглядно это свойство
можно представить как возможность вращения электрона вокруг своей оси. Если два электрона вращаются вокруг собственной оси в одном направлении, то говорят, что их спины параллельны, а если в разных направлениях — то их спины антипараллельны (рис. 13.1).
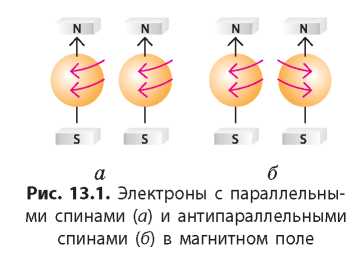
Таким образом, одна орбиталь может содержать только такие два электрона, спины которых являются антипараллельными. Это правило называют принципом запрета Паули:
На одной орбитали могут находиться не более двух электронов, причем их спины должны быть антипараллельными.
Графически орбиталь изображают в виде квадрата, а электроны — в виде стрелок, направленных вверх или вниз, показывающих направление спина электрона. Стрелки, направленные в противоположные стороны, обозначают электроны с противоположными спинами:


Австрийский и швейцарский физик, лауреат Нобелевской премии по физике 1945 г. Еще школьником прочитал труд Эйнштейна о теории относительности. В 20 лет написал статью об общей и специальной теории относительности, которую одобрил сам Эйнштейн. Работал ассистентом у Нильса Бора. Высказал предположение, что электронам присуще свойство, которое позднее назвали спином. Сформулировал закон, известный как принцип запрета Паули, который является фундаментальным для понимания строения атомов, атомных ядер, свойств металлов и других физических явлений. За его личностные качества и склонность к беспощадному критическому анализу коллеги называли его «совестью физики».
Принцип наименьшей энергии
Все химические свойства веществ определяются строением электронных оболочек атомов. Для того чтобы описать электронное строение атома, необходимо знать, как именно распределены электроны по его орбиталям. Давайте рассмотрим, как электроны заполняют электронные орбитали атомов.
Электроны занимают орбитали последовательно, начиная с первого энергетического уровня, в порядке возрастания энергии уровней.
Сначала «заселяется» первый энергетический уровень, затем — второй, третий и т. д. Этот принцип называют принципом наименьшей энергии.
Число энергетических уровней, заполняемых в атоме элемента, определяют по номеру периода Периодической системы, в котором расположен этот химический элемент.
Так, в атомах химических элементов первого периода заполняется только первый энергетический уровень, в атомах элементов второго периода — первые два энергетических уровня, третьего — три и т. д.
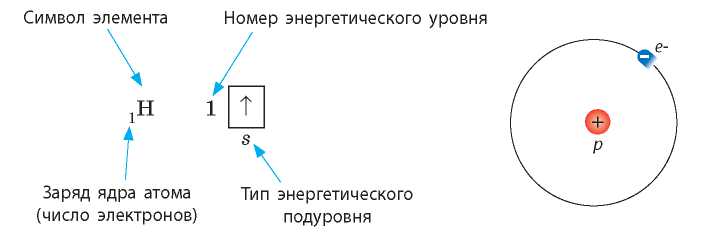
Например, Гидроген расположен в первом периоде под номером 1. Это означает, что в электронной оболочке его атомов имеется только один электрон, который находится на первом энергетическом уровне на единственной s-орбитали.
Графически строение электронной оболочки атомов Гидрогена записывают следующим образом:
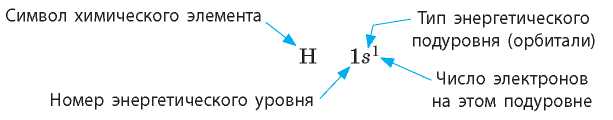
Кроме графического изображения строения электронной оболочки используют также ее запись в виде электронной формулы (электронной конфигурации), в которой приводят все занятые энергетические подуровни с указанием числа электронов на каждом из них.
Электронная формула Гидрогена выглядит так:
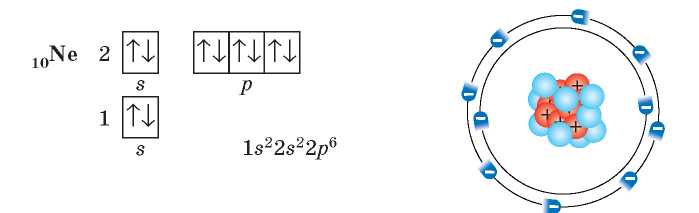
Гелий также расположен в первом периоде, следовательно, в электронной оболочке его атомов также заполняется первый энергетический уровень, который состоит из одной s-орбитали. Но на этой орбитали уже находится два электрона, так как порядковый номер Гелия — 2. Согласно принципу Паули, на одной орбитали эти электроны имеют антипараллельные спины:

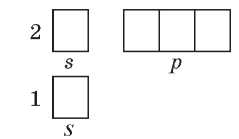
У элементов второго периода начинает заполняться электронами второй энергетический уровень. На втором уровне уже два подуровня: s-подуровень (одна орбиталь) и ^-подуровень (три орбитали):
Независимо от числа энергетических уровней электроны сначала заполняют самый низкий уровень, т. е. в данном случае первый, а затем уже второй. Например, рассмотрим строение электронной оболочки Лития, которая содержит три электрона (порядковый номер — 3). Поскольку первый уровень максимально вмещает два электрона, то на втором должен находиться только один электрон. Как вы считаете, какую орбиталь «выберет» третий электрон? Согласно принципу наименьшей энергии, каждый электрон располагается так, чтобы его энергия была наименьшей, следовательно, среди свободных орбиталей он выбирает орбиталь с наиболее низкой энергией.
Среди всех орбиталей s-орбитали обладают наименьшей энергией, поэтому единственный электрон второго энергетического уровня будет занимать s-орбиталь, а ^-орбитали в данном случае останутся свободными:

Рассмотрим строение электронной оболочки Бериллия. Его четвертый электрон также должен выбрать ту же орбиталь, что и третий электрон Лития. До тех пор, пока не заполнится текущий подуровень, следующий заполняться не начинает. Так, в атоме Бериллия (порядковый номер — 4) полностью заполнен s-подуровень, образуя электронную пару, а ^-подуровень снова остается свободным:

Только если s-орбиталь заполнена, электроны начинают располагаться на ^-орбиталях. Так, в атоме Бора (порядковый номер — 5) на ^-орбитали уже появляется один электрон:

Анализируя электронные формулы последних трех расмотренных элементов, можно сделать вывод, что у других элементов второго периода также будут заполняться электронами орбитали первых двух
энергетических уровней, а электронная оболочка каждого следующего элемента будет отличаться от электронной оболочки предыдущего только на один электрон.
Распределение электронов по орбиталям на энергетическом подуровне
Часто бывают случаи, когда на подуровнях, состоящих из нескольких орбиталей, размещается несколько электронов. Возникает вопрос: какие орбитали они занимают? Например, если на ^-подуровне находится два электрона, то они могут занять или одну ^-орбиталь, или две разные ^-орбитали:
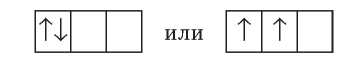
Для такого случая существует правило, согласно которому электрон занимает свободную орбиталь, а при отсутствии свободной — образует пару с другим электроном в полузаполненной орбитали. Так же, как и люди в троллейбусе сначала садятся на свободные места, а если свободных мест нет, то подсаживаются к другим пассажирам. Это правило называют правилом Хунда:
В пределах одного энергетического подуровня электроны распределяются по орбиталям таким образом, чтобы число неспаренных электронов было максимальным.

Немецкий физик-теоретик. Родился в городе Карлсруэ. В возрасте 26 лет закончил Геттингенский университет. На протяжении следующих 40 лет работал почти во всех известных университетах Германии. Важнейшие труды Хунда посвящены квантовой механике, спектроскопии атомов и молекул, магнетизму, квантовой химии и истории физики. В 1927 г. сформулировал эмпирические правила, регулирующие порядок заполнения атомных орбиталей электронами (правила Хунда). Ввел представление о сигма- и пи-связях. Вместе с Маликеном и Лен-нард-Джонсом участвовал в разработке нового метода квантовой химии — метода молекулярных орбиталей.
Согласно этому правилу, в электронной оболочке атома Карбона есть два неспаренных электрона:

Только если на ^-подуровне должно расположиться более трех электронов, то «лишний» электрон образует электронную пару с другим электроном, который уже размещен на этом подуровне:

Таким образом, в атомах Неона первый и второй энергетические подуровни полностью заполнены электронами:
Строение электронных оболочек атомов элементов третьего и четвертого периодов
Электронные оболочки атомов элементов других периодов заполняются по таким же правилам. Так, у атомов первого элемента
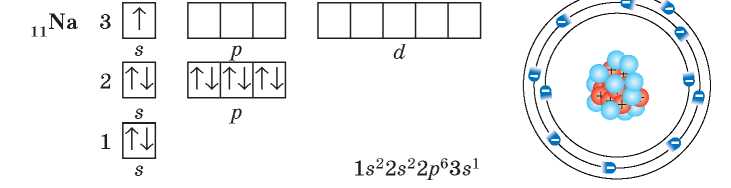
Обратите внимание, что в атоме Натрия на третьем энергетическом уровне появляется третий подуровень, который состоит из d-орбиталей. Но, как и ^-орбитали, у Натрия орбитали d-подуровня еще не заполняются электронами и остаются свободными.
третьего периода — Натрия — начинает заполняться третий энергетический уровень:
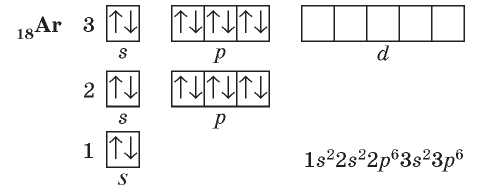
В атомах последнего элемента третьего периода — Аргона — полностью заняты все s- и ^-орбитали:
В атомах элементов четвертого периода начинает заполняться электронами четвертый энергетический уровень, несмотря на то что третий уровень еще не заполнен. Это связано с тем, что энергия 4s-подуровня меньше, чем энергия 3^-подуровня, хотя в данном случае d-подуровень расположен на более близком к ядру электронном уровне. В атомах первого элемента четвертого периода — Калия — один электрон располагается на 4s-подуровне:
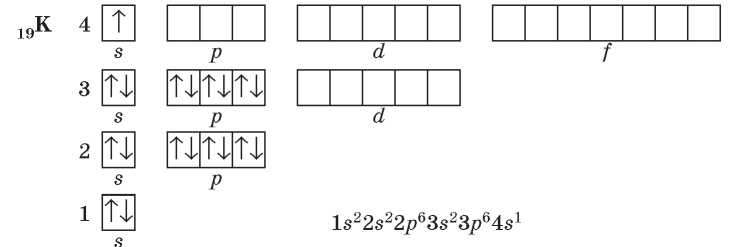
У следующего элемента — Кальция — 4з-подуровень заполнен полностью.
Итак, мы рассмотрели основные принципы, которые помогут понять строение электронных оболочек атомов первых двадцати химических элементов. Эти принципы являются универсальными и распространяются также и на другие элементы. Но для других элементов необходимо применять еще некоторые дополнительные правила, которые вы узнаете при более глубоком изучении химии.
Сравнить энергию разных электронных подуровней можно при помощи суммы двух чисел (л + /). Число п — это номер энергетического уровня, на котором находятся орбитали, а l — это число, соответствующее энергетическому подуровню (типу орбитали). Так, для s-орбиталей l = 0, для р-орбиталей l = 1, для d-орбиталей l = 2, для /-орбиталей l = 3. Согласно правилу Клечковского, подуровни заполняются электронами в порядке увеличения суммы (n + l). Если для двух подуровней эта сумма одинаковая, то заполняется тот подуровень, который находится на более близком к ядру электронном уровне. Так, для 4s-подуровня сумма (n + l) равна 4 + 0 = 4, а для 3^-подуровня сумма (n + l) равна 3 + 2 = 5. Следовательно, энергия 4s-подуровня меньше, чем 3^-подуровня, поэтому он заполняется раньше. Таким образом можно сравнивать энергии любых энергетических подуровней.
Интеллектуальные способности Паули значительно превосходили его «умение» работать руками. Коллеги обычно шутили по поводу таинственного «эффекта Паули», когда при появлении невысокого полноватого ученого в лаборатории случались поломки и аварии.
Выводы
1. На одной орбитали может находиться не более двух электронов, причем их спины должны быть антипараллельными. Орбитали заполняются электронами по принципу наименьшей энергии: сначала заполняется первый энергетический уровень, затем — второй и третий.
2. Если на одном энергетическом подуровне находится несколько электронов, то они распределяются таким образом, чтобы число неспаренных электронов было максимальным.
Контрольные вопросы
1. Сколько электронов может максимально находиться на одной электронной орбитали?
2. Сколько электронов максимально может находиться на s-подуровне? р-подуровне? d-подуровне?
3. Какой энергетический уровень заполняется раньше: первый или второй? Ответ поясните.
4. Почему в атоме Лития электрон, расположенный на втором электронном уровне, находится на s-орбитали, а не на р-орбитали?
5. Как распределяются электроны по орбиталям на р-подуровне?
6. Сколько электронов находится на внешнем энергетическом уровне атомов: а) Гелия; б) Лития; в) Бериллия; г) Бора; д) Карбона; е) Оксигена?
7. Сколько энергетических уровней заняты электронами в атомах: а) Лития, Натрия, Калия; б) Бериллия, Магния, Кальция; в) Флуора, Хлора, Брома?
Задания для усвоения материала
1. Составьте графическую электронную формулу Нитрогена, Флуора, Магния, Алюминия и Силиция. Определите число электронных пар и неспаренных электронов на внешнем энергетическом уровне.
2. По числу орбиталей, составляющих энергетические уровни, определите, какое максимальное число электронов может находиться на втором и третьем энергетических уровнях.
3. Назовите два химических элемента, в атомах которых полностью заполнены внешние энергетические уровни.
4. Сколько неспаренных электронов в электронной оболочке атома Оксигена? Атомы какого еще химического элемента второго периода содержат такое же число неспаренных электронов?
5. Изобразите строение электронных оболочек атомов Нитрогена и Фосфора. Что общего в строении электронных оболочек этих атомов и чем они отличаются?
6. Атомы каких элементов имеют следующую электронную формулу внешнего электронного уровня: а) 1s2; б) 2s2; в) 2s22p4; г) 3s23p2; д) 4s2?
7. Атом какого элемента второго периода содержит наибольшее число: а) электронов; б) неспаренных электронов; в) электронных пар?
Это материал учебника Химия 8 класс Григорович
Автор: admin от 16-09-2016, 23:29, Переглядів: 5859