§ 43. Розв'язування експериментальних задач
Пригадайте: класифікацію неорганічних сполук;
хімічні властивості вивчених сполук загальні способи добування оксидів та солей, кислот і основ.
Експериментальні методи в хімії
Хімія — наука експериментальна. Переважна більшість знань у вигляді теорій та законів була відкрита дослідницьким шляхом, ґрунтуючись на хімічних і фізичних властивостях речовин та кількісних характеристиках, що описують їх взаємодії. Навіть якщо певна теорія спочатку була висловлена за певними міркуваннями, усе одно вона вимагала експериментального доведення. Як говорять науковці: «Практика — критерій істини».
У сучасних хімічних лабораторіях більшість експериментів проводять з використанням спеціальних інструментів. Для визначення кислотності розчинів замість індикаторів частіше використовують

pH-метр (мал. 43.1). Ще 50 років тому для визначення вмісту атомів того чи іншого хімічного елемента в сполуці використовувалися різні хімічні реакції, деякі з них проводилися протягом тривалого часу. Сучасний елементний аналізатор (мал. 43.2) дозволяє визначити вміст будь-якого хімічного елемента в зразку речовини за лічені хвилини.
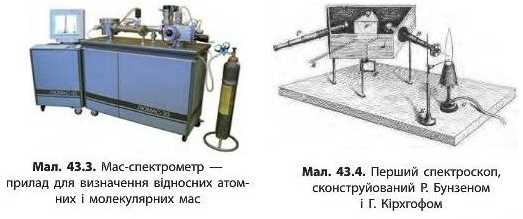
Уже 200 років хіміки користуються відносними атомними масами елементів. Для визначення атомних мас раніше необхідно було провести численні експерименти з визначення масових співвідношень реагентів. Сьогодні для цього використовують мас-спектрометри (мал. 43.3), що дозволяють визначити маси не тільки окремих атомів, але й багатьох молекул і йонів.
Для висновків щодо властивостей речовин часто необхідно знати оптичні характеристики речовин, зокрема світло якого кольору поглинає речовина. Наприкінці XIX ст. німецькі вчені Роберт Бун-зен та Густав Кірхгоф сконструювали найпростіший спектрограф (мал. 43.4), який за оптичними характеристиками речовин дозволив

визначити склад Сонця, відкрити нові речовини, зокрема інертні гази тощо. Сучасні вчені також активно користуються таким приладом, але, звісно, суттєво переробленими (мал. 43.5). Він дозволяє розв’язувати набагато складніші задачі, але принцип його дії багато в чому нагадує спектроскоп Вунзена.
Сьогодні дуже поширеним експериментальним методом є метод ядерного магнітного резонансу (ЯМР-спектроскопія). Він дозволяє робити висновки про будову молекул і став майже незамінним у сучасній хімії (мал. 43.6).
Без сучасних приладів сьогодні складно уявити роботу хіміків, без нового обладнання неможливий подальший розвиток і накопичення хімічних знань. Але багато задач можна розв’язувати і без приладів, використовуючи звичайні реактиви і проводячи досліди у звичайних пробірках.
Розв'язування експериментальних задач
І в сучасній лабораторії, і у звичайній шкільній хімічній лабораторії часто постають задачі, які можна розв’язати тільки дослідним шляхом. Наприклад, необхідно визначити склад певної речовини, склянку з якою хтось забув підписати. Або необхідно довести, чи дійсно вміст певної склянки відповідає надпису на ній.
Для розв’язування таких експериментальних задач необхідно знати візуальні ефекти, що супроводжують ті чи інші реакції. Зокрема, зміна забарвлення індикаторів за наявності тих чи інших речовин, утворення осаду при взаємодії певних речовин, виділення газів та характер запахів цих газів. Необхідно також пам’ятати, що
більшість газуватих речовин безбарвні, але деякі з них (сірководень або сірчистий газ) мають певний характерний запах. А наявність інших речовин доводять у хімічний спосіб: кисень підтримує горіння тліючої скіпки, а водень сам здатний згоряти з характерним звуком.
Для розв’язз'вання будь-якої експериментальної задачі завжди слід дотримуватися певної послідовності. По-перше, необхідно скласти план експерименту, у межах якого визначити, на яке конкретне запитання потрібно дати відповідь і які досліди необхідно провести для цього. По-друге, виконати власне експериментачьну частину. По-третє, зробити висновок, чи дозволяють проведені досліди дати відповідь на поставлене питання і які результати дослідів дозволяють зробити висновок про доведення або спростування початкових припущень. Розглянемо декілька прикладів розв’язування експериментальних задач.
Задача 1. Експериментальним методом доведіть склад хлоридної кислоти.
Розв'язання:
1. Планування експерименту.
Хлоридна кислота складається з йонів Гідрогену та хлорид-іонів. Для доведення її складу необхідно провести досліди, що виявлять наявність цих йонів.
Доведення наявності Гідрогену можна провести кількома способами. Перший: завдяки наявності йонів Гідрогену кислоти змінюють забарвлення індикаторів. Отже, якщо індикатор змінить своє забарвлення на колір, що відповідає кислому середовищу, то можна стверджувати про наявність Гідрогену у складі кислоти. Другий спосіб ґрунтується на можливості витиснути йони Гідрогену з кислоти активними металами.
Довести наявність хлорид-іонів можна додаванням до хлоридної кислоти розчину аргентум(І) нітрату, оскільки при цьому має утворитися білий осад аргентум хлориду.
Проведення експерименту.
Наллємо виданий розчин хлоридної кислоти в три пробірки. По черзі додаємо необхідні реактиви та записуємо свої спостереження в зошит (лабораторний журнал). Результати експерименту зручніше оформити у вигляді такої таблиці:
|
Номер иробірки |
Проведеш дії |
Спостереження |
|
1 |
Додаємо розчин лакмусу |
Лакмус змінює забарвлення на червоне |
|
2 |
Додаємо гранулу цинку |
На поверхні цинку утворюються бульбашки безбарвного газу і виділяються з розчину |
|
Газ, що виділяється, збираємо у пробірку, повернуту догори дном, і підпалюємо |
Газ згоряє з характерним гавкаючим звуком |
|
|
3 |
Додаємо розчин аргентум(І) нітрату |
Утворюється білий сирнистий осад |
|
Додаємо декілька крапель нітратної кислоти |
3 осадом нічого не відбувається |
Аналіз експерименту і формулювання висновків.
Червоним лакмус стає в розчинах кислот, а в усіх кислотах наявний Гідроген. Наявність Гідрогену доводить також другий дослід. В указаний спосіб згоряє тільки водень, а він міг утворитися при взаємодії кислоти із цинком. Отже, у хл ори дній кислоті містяться йони Гідрогену. Білий сирнистий осад, нерозчинний у нітратній кислоті, утворюється при додаванні HpreHTjrrM(I) нітрату тільки до хлоридів. Отже, розчин є розчином хлориду. Проведені експерименти доводять, що в розчиненій речовині містяться Гідроген і Хлор, тобто ця речовина — гідроген хлорид (хлоридна кислота).
Задача 2. У трьох пронумерованих пробірках містяться розчини хлоридної кислоти, натрій хлориду та натрій сульфіту. Використовуючи мінімальне 'гасло реактивів, визначте вміст кожної пробірки.
Розв'язання:
1. Планування експерименту.
Серед трьох речовин одна — кислота, наявність якої можна довести індикатором. Отже, першою дією необхідно випробувати вміст пробірок індикатором. Наявність хлоридів можна визначити, використовуючи аргентум(І) нітрат. Але, аргентум сульфіт, що має утворитися за наявності натрій сульфіту, також нерозчинний, тож така проба нам не дозволить розрізнити вміст пробірок. Використовуючи таблицю розчинності, визначаємо, що існує реактив, при додаванні якого до сульфітів осад утворюється, а до хлоридів — ні. Це барій нітрат. Отже, його можна використати для виявлення пробірки з розчином натрій сульфіту. Наявність сульфітів можна також довести
додаванням сильної кислоти. Оскільки сульфітна кислота слабка, то сильні кислоти витискатимуть її із солі. До того ж, вона нестійка і розкладатиметься з виділенням сірчистого газу, який можна виявити за характерним запахом.
2. Проведення експерименту.
Оскільки з кожною речовиною необхідно провести щонайменше дві реакції, то вміст кожної пробірки розділяємо на дві порції. Результати дослідів оформлюємо у вигляді таблиці:
|
Проведені дії |
Номер пробірки |
||
|
1 |
2 |
3 |
|
|
1. Додаємо розчин метилового оранжевого |
Забарвлення не змінюється |
Індикатор змінює забарвлення на червоне |
Забарвлення не змінюється |
|
2. Додаємо розчин барій нітрату |
Випадає білий осад |
Нічого не відбувається |
Змін не відбувається |
о. Аналіз експерименту і формулювання висновків.
Індикатор змінює забарвлення за наявності кислот, і це відбувається тільки в одній пробірці. Отже, у пробірці 2 — хлоридна кислота. Осад утворюється при додаванні барій нітрату тільки до вмісту першої пробірки, отже, пробірка 1 містить натрій сульфіт. Методом виключення робимо висновок, що в пробірці 3 — натрій хлорид.
Розв'язування експериментальних задач
Обладпипня: штатив із пробірками.
Реиктиви: розчини: нітратна кислота, кальцій гідроксид, кальцій хлорид, натрій сульфіт, натрій сульфат, барій хлорид, барій гідроксид, барій нітрат, аргентум нітрат, натрій хлорид, метиловий оранжевий.
Правила безпеки:
• при виконанні дослідів використовуйте невеликі кількості реактивів;
• остерігайтеся потрапляння реактивів на одяг, шкіру, очі; у разі потрапляння негайно змийте речовину великою кількістю води та протріть місце розбавленим розчином: якщо луг — розчином боратної кислоти, якщо кислота — розчином соди.
Дослід 1. Ґрунтуючись на схемі генетичного зв’язку між класами неорганічних сполук, запропонуйте по три способи добування кальцій сульфіту і барій сульфату. Добудьте кожну сіль не менш як двома способами, використовуючи видані вам реактиви.
Дослід 2. У трьох пронумерованих пробірках містяться розчини нітратної кислоти, барій нітрату та аргентум(І) нітрату. Використовуючи мінімальне число реактивів, визначте вміст кожної пробірки.
Висновки
Для розв'язування експериментальних задач використовують досліди, у яких відбуваються характерні візуальні явища: випадання осаду, виділення газу або зміна забарвлення індикатору. Для розв’язування експериментальної задачі необхідно спланувати експеримент, визначивши, які візуальні ефекти мають супроводжувати ту чи іншу реакцію. Після проведення дослідів необхідно зробити висновок про правильність планування експерименту, доцільність дослідів та, Грунтуючись на спостереженнях, дати відповідь на поставлене запитання.
Контрольні запитання
1. Які інструментальні методи дослідження речовин вам відомі? Для чого їх використовують?
2. Схарактеризуйте етапи розв'язування експериментальних задач.
3. На яких принципах ґрунтується доведення складу тих чи інших речовин?
Завдання для засвоєння матеріалу
1. Які реактиви можна використовувати для доведення наявності розчинних у воді: а) хлоридів; б) сульфатів; в) бромідів; г) йодидів; д) ор-тофосфатів; е) сульфідів; є) карбонатів? Складіть рівняння реакцій.
2. Які реактиви можна використати для доведення наявності розчинних у воді солей: а) Барію; 6) Кальцію; в) Алюмінію; г) Мангану(ІІ); д) Арген-туму; е) Плюмбуму(ІІ); є) Феруму(ІІІ); ж) Феруму(ІІ); з) Купруму(ІІ)? Складіть відповідні рівняння реакцій.
3. Експериментально доведіть склад: а) сульфатної кислоти; б) ферум(ІІ) хлориду; в) барій сульфіду; г) магній сульфату. Складіть рівняння реакцій.
4. У двох пробірках міститься натрій сульфат і натрій сульфіт. До обох пробірок додали розчин барій нітрату. При цьому в обох пробірках утворився білий осад. У який спосіб можна відрізнити ці два осади? Складіть відповідні рівняння реакцій.
5. У двох пробірках містяться магній сульфат та цинк сульфат. До першої пробірки додали розчин калій гідроксиду і утворився білий драглистий осад, що розчинився при подальшому додаванні лугу. До другої також додали розчин лугу, але утворений осад при подальшому до-
даванні лугу не розчинився. Визначте вміст кожної пробірки. Складіть відповідні рівняння реакцій.
6. У який спосіб можна розрізнити розчини хлоридів феруму(ІІІ), Магнію і Барію? Складіть відповідні рівняння реакцій.
7. У який спосіб можна розрізнити між собою розчини нітратів Калію, Кальцію, Алюмінію і Феруму(ІІ)?
Розв'язування експериментальних задач
Обладнання: штатив із пробірками, пальник, шпатель, лійка, фільтрувальний папір.
Реактиви: лакмус, барій нітрат, калій гідроксид, натрій хлорид, сульфатна кислота, хлоридна кислота, нітратна кислота, натрій сульфат, купрум(ІІ) хлорид, натрій ортофосфат, фе-рум (III) хлорид.
Правила безпеки:
• використовуйте невеликі кількості реактивів;
• остерігайтеся потрапляння реактивів на одяг, шкіру, в очі; у разі потрапляння лугу або кислоти її слід негайно змити великою кількістю води та протерти місце розбавленим розчином боратної кислоти (у випадку потрапляння лугу) або розчином соди (у випадку кислоти).
Використовуючи надані вам реактиви, продумайте, у який спосіб можна розв’язати задачі, і проведіть відповідні досліди. У зошиті складіть план експерименту, запишіть свої спостереження, відповідні рівняння реакцій та зробіть висновки.
Завдання 1. У трьох пробірках містяться розчини калій гідроксиду, сульфатної кислоти та натрій хлориду. Використовуючи мінімальне число реактивів, визначте вміст кожної пробірки.
Завдання 2. У трьох пробірках містяться натрій сульфат, натрій хлорид та сульфатна кислота. Визначте за допомогою не більше ніж двох реактивів уміст кожної пробірки.
Завдання 3. Із купрум(ІІ) хлориду добудьте купрум(ІІ) нітрат.
Завдання 4. Здійсніть такі хімічні перетворення: ферум(ІИ) хлорид —» ферум(ІІІ) гідроксид —» ферум(ІН) оксид —> ферум(ІІІ) нітрат —» ферум(ІІІ) ортофосфат.
Перевірте свої знання за темою «Основні класи органічних сполук».
Це матеріал з підручника Хімія 8 клас Григорович
Автор: admin от 13-09-2016, 18:20, Переглядів: 10408