§ 35. Хімічні властивості кислот
Пригадайте: для визначення розчинності речовин у воді використовують таблицю розчинності;
як виявляють луги в розчині (за § 33);
фізичні властивості кислот (за § 34);
принцип кислотно-основних взаємодій (за § 30), умови, за яких відбуваються реакції обміну (за § 33).
Виявлення кислот
Як і луги, кислоти можна виявити за допомогою індикаторів. Забарвлення індикаторів за наявності та за відсутності кислот у розчині наведені в таблиці 11.
Таблиця 11. Забарвлення індикаторів за наявності та за від-CVTHOCTl кислот
|
Індикатор |
Забарвлення в розчині |
|
|
За наявності кислот (кисле середовшце) |
За відсутності кислот (нейтральне середовшце) |
|
|
Лакмус |
Червоний |
Фіолетовий |
|
Метиловий оранжевий |
Червоний |
Оранжевий |
|
Фенолфталеїн |
Безбарвний |
Безбарвний |
|
Універсальний |
Червоний |
Жовтий |

Видатний український та польський фізик, член Польської Академії наук. Народився в селі Воскресенівка Харківської губернії. Навчався в Харківському, Варшавському та Берлінському університетах. Був пристрасним музикою і в час навчання був першою скрипкою у Варшавській опері. Довгий час займав посаду професора в університеті Торуня. Яблонський — піонер у молекулярній фотофізиці. Відомі його дослідження в галузі фотолюмінесценції і спектральної теорії молекул. Дослідив багато органічних барвників, що використовують як флуоресцентні кислотно-основні індикатори. Запропонував схему для пояснення процесів взаємодії молекул зі світлом, яку сьогодні називають «діаграмою Яблонського».
Взаємодія кислот з речовинами основної природи
Ви вже вивчили реакції оснбвних оксидів та основ з кислотами. Між ними відбуваються реакції обміну, у яких утворюються сіль та вода:
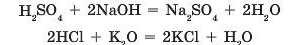
Δ £
Амфотерні оксиди та амфотерні гідроксиди у взаємодії з кислотами виявляють властивості основних речовин, тобто реагують як звичайні основні оксиди та гідроксиди:
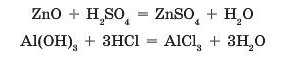
Взаємодія кислот із солями
Кислоти можуть вступати в реакцію із солями (як розчинними у воді, так і нерозчинними). Між кислотою та сіллю відбувається реакція обміну, отже продуктами реакції мають бути також сіль і кислота.
Взаємодія між сіллю і кислотою відбувається, якщо реакція відповідає умовам перебігу реакцій обміну:
• кислота або сіль, що утворюється, випадає в осад:
сіль (1) + кислота (1) —> нерозчинна сіль (2)і + кислота (2)
або
сіль (1) + кислота (1) —> сіль (2) + нерозчинна кислота (2)1
Наприклад, при взаємодії барій хлориду із сульфатною кислотою утворюється білий осад нерозчинної солі — барій сульфату:
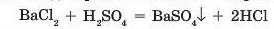
Серед відомих вам кислот нерозчинною є силікатна кислота, вона утворюється в реакції розчинних силікатів з кислотами:

• виділення газуватої речовини, що можливо, якщо утворена кислота нестійка або летка:
сіль (1) + кислота (1) —> сіть (2) + нестійка або летка кислота (2)Т |
При взаємодії карбонатів або сульфітів з кислотами утворюються нестійкі кислоти (карбонатна й сульфітна), які при утворенні розкладаються:
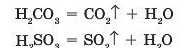
Тому такі солі активно реагують з кислотами. Наприклад, при дії на порошок кальцій карбонату (вапняк, крейда, мармур) хло-ридної кислоти рідина ніби закипає, оскільки утворена карбонатна кислота моментально розкладається і при цьому виділяється багато вуглекислого газу (мал. 35.1):
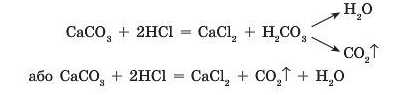
Аналогічно відбувається реакція при взаємодії натрій сульфіту з кислотою:
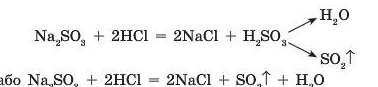
Деякі кислоти є леткими і погано розчиняються у воді, як, наприклад, сульфідна кислота HaS. При дії хлоридної кислоти на ферум(ІІ) сульфід реакція відбувається завдяки виділенню із розчину гідроген сульфіду (сірководню) — газу із запахом тухлих яєць:
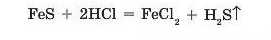

Варто пам'ятати, що реакції кислот із солями не завжди відбуваються, навіть якщо формально реакція відповідає умовам протікання реакцій обміну. Так, якщо змішати розчини ферум(ІІ) хлориду і сульфідної кислоти, то реакція не відбуватиметься, хоча в результаті має утворитися осад:
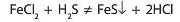
Справа полягає в силі кислот. Кислоти поділяють на сильні та слабкі. Сильними кислотами є H3SO4, HNO3, НСІ, HBr та НІ. Інші кислоти, що наведені в таблиці 12, є слабкими. Отже, хлоридна кислота є сильною, а сульфідна — слабкою. Взаємодія ферум(ІІ) хлориду із сульфідною кислотою не може відбуватися, тому що слабка кислота не може витиснути сильну із солі. Взаємодія може відбуватися тільки у зворотному напрямку. Сильна кислота може витиснути слабку із солі:
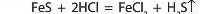
Отже, усі сильні кислоти здатні взаємодіяти із солями всіх слабких кислот. Незважаючи на те, що багато слабких кислот розчинні у воді, сильні кислоти здатні витиснути їх навіть у тому випадку, якщо всі продукти реакції розчинні у воді. Наприклад, сульфатна кислота навіть може витиснути ортофосфатну з нерозчинних ортофосфатів:
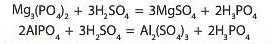
Безпека при роботі з кислотами
Кислоти — їдкі речовини. При потраплянні на шкіру або слизові оболонки кислоти можуть спричинити хімічні опіки, а в разі концентрованої сульфатної кислоти — навіть обвуглювання шкіри. При потраплянні кислоти на одяг можуть з’явитися дірки. Тому з кислотами, особливо з концентрованими, слід поводитися дуже обережно. Працювати з ними бажано в гумових рукавичках. Якщо кислота випадково потрапила на шкіру або одяг, її слід негайно змити великою кількістю води, а залишки нейтралізувати розбавленим розчином соди.
При розчиненні концентрованих кислот у воді виділяється велика кількість теплоти.
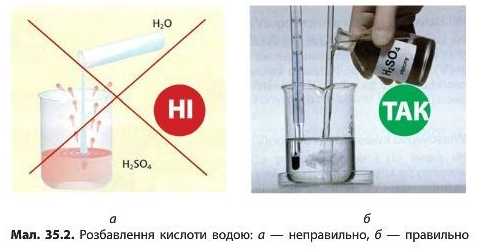
Якщо наливати воду в склянку з концентрованою кислотою, то вода збирається на поверхні (густина концентрованих кислот більша за воду) і під впливом теплоти може закипіти та почати розбризкуватися разом з кислотою. Тому при розбавленні концентрованих кислот обов’язково слід наливати кислоту в склянку з водою, а не навпаки (мал. 35.2, с. 192).
• У XIX ст. з'явилися так звані «макальні сірники» — майже звичайні сірники, які загорялися не від тертя, а в разі вмочування їх у концентровану сульфатну кислоту. Разом із цими сірниками продавалися склянки з кислотою. Але, певна річ, користуватися ними було вкрай незручно та небезпечно.
• Під дією хлоридної кислоти гине більшість бактерій, що потрапили у шлунок. Таку саму дію на мікроорганізми чинить й оцтова кислота. Саме тому її розчин часто використовують для консервування продуктів харчування.
• Деякі органічні речовини рослин виявляють властивості кислотно-основних індикаторів. Індикаторні властивості виявляють соки червоної капусти, барвінку, буряку, чорниці, бузку, фіалки тощо. Також за наявності кислот змінюють свій колір борщ та чай.
Дія водних розчинів кислот на індикатори
Обладнання: штатив з пробірками, піпетки.
Реактиви: 5%-й розчин хлоридної кислоти, розчин сульфатної кислоти, лакмус, метиловий оранжевий, фенолфталеїн та універсальний індикатор.
Правила безпеки:
• при виконанні дослідів використовуйте невеликі кількості реактивів;
• при визначенні запаху речовин не підносьте посудину до обличчя, а спрямовуйте повітря рухами руки в напрямку до себе;
• остерігайтеся потрапляння реактивів на одяг, шкіру, в очі; у разі потрапляння кислоти її слід негайно змити великою кількістю води та промити шкіру розбавленим розчином соди.
1. Відкрийте склянку з 5%-м розчином хлоридної кислоти. Перевірте, чи має вона запах.
2. Налийте в чотири пробірки по 1 мл розчину хлоридної кислоти.
3. У першу пробірку додайте 1-2 краплі розчину лакмусу, у другу — метилового оранжевого, у третю — фенолфталеїну, у четверту — універсального індикатору. Як змінилося забарвлення індикаторів?
4. Виконайте аналогічні дії з розчином сульфатної кислоти.
5. Запишіть спостереження в зошит. Що спільного між хлорид-ною і сульфатною кислотами? Чим вони розрізняються? Порівняйте результати вашого досліду з даними із таблиці на форзаці.
Дія на сік буряка лимонного соку, розчинів харчової соди, мильного розчину
Вам знадобляться: каструля, буряк, ніж, лійка, фільтрувальний папір або фільтр для кавоварки, лимонний сік, оцет, харчова сода, пральний пиришик та розчин мила.
Правила безпеки:
• при виконанні дослідів використовуйте невеликі кількості речовин;
• остерігайтеся потрапляння кислих речовин на шкіру, в очі; у разі потрапляння слід змити речовину великою кількістю води;
• пам’ятайте, що гарячі та холодні предмети однакові на вигляд, користуйтеся захисними рукавичками.
У деяких рослинах є речовини, що можна використовувати як індикатори. Для початку слід добути розчин індикатору з буряка. Це можна зробити в різні способи: вичавити сік з буряка за допомогою соковижималки або приготувати відвар з буряка. Для цього
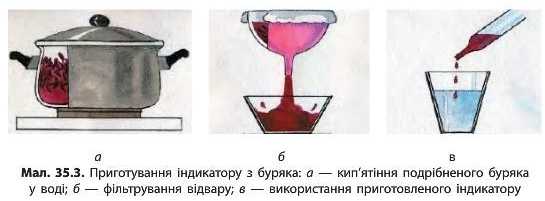
наріжте невеликий буряк тонкими скибочками або соломкою. Помістіть його в окріп (приблизно 0,5 л), щоб відвар вийшов досить концентрованим. Дайте покипіти декілька хвилин, після цього остудіть та відфільтруйте відвар від залишків буряка з використанням паперового фільтра або фільтра для кавоварки (мал. 35.3).
Приготуйте шість склянок і налийте в кожну по 50 мл води. У першу склянку додайте столову ложку оцту, у другу — сік одного лимона, у третю насипте пів чайної ложки соди, у четверту — стільки ж прального порошку, у п’ятій склянці розчиніть невеликий шматочок мила, а в шостій залиште чисту воду для порівняння. Можна також заготовити склянку з розсолом від маринованих огірків або помідорів, із соком квашеної капусти, свіжим та кислим молоком.
До кожної склянки прилийте невеликий об’єм (5—10 крапель) соку або відвару буряка. Як змінюється забарвлення?
Запишіть свої спостереження в зошит. Зробіть висновки:
1) як змінюється забарвлення соку (відвару);
2) у яких склянках містились кислоти, я R яких — луги;
3) чи можна сік (відвар) буряка використовувати як індикатор.
Цей експеримент можна повторити, узявши замість буряка червону капусту, пелюстки фіалок, ірисів або інших яскраво забарвлених квітів, а також звичайну зеленку (розчин «Брильянтового зеленого» з домашньої аптечки).
Висновки
1. Для виявлення кислот використовують ті самі індикатори, що й для виявлення лугів. Лакмус, метиловий оранжевий та універсальний індикатор за наявності кислот змінюють своє забарвлення на червоне, а фенолфталеїн залишається безбарвним.
2. Кислоти реагують з речовинами основної природи: основами та основними оксидами. У результаті такої взаємодії утворюються сіль та вода. Амфотерні оксиди та амфотерні гідроксиди реагують з кислотами так само.
3. Кислоти здатні вступати із солями в реакції обміну. При цьому утворюються інші кислота та сіль. Реакція відбуватиметься у випадку утворення леткої чи нестійкої кислоти або при утворенні нерозчинної солі чи кислоти.
4. Кислоти — їдкі речовини, з якими слід поводитися дуже обережно. При розбавленні кислот необхідно вливати кислоту у воду, а не навпаки. При потраплянні кислоти на шкіру або одяг, її слід негайно змити великою кількістю води та нейтралізувати залишки розчином соди.
Контрольні запитання
1. Речовини якого класу сполук утворюються при взаємодії кислоти з основою чи основним оксидом?
2. Які речовини утворюються в реакції обміну між кислотою та сіллю? Завдання для засвоєння матеріалу
1. Складіть рівняння реакцій нітратної кислоти з магній оксидом та магній гідроксидом.
2. Складіть рівняння реакції взаємодії сульфатної кислоти з такими сполуками: купрум(ІІ) гідроксид, кальцій гідроксид, алюміній оксид, цинк гідроксид, калій сульфіт, натрій сульфід, калій карбонат, купрум(ІІ) сульфід. У всіх випадках визначте, завдяки чому відбувається реакція обміну.
3. Які оксиди при взаємодії з хлоридною кислотою утворюють такі солі: CaCI2, HgCI2, FeCI3? Складіть рівняння цих реакцій.
4. Які з наведених речовин можна використати для поглинання вуглекислого газу з повітря: розчин натрій гідроксиду, розчин сульфатної кислоти, фосфор(У) оксид, кальцій гідроксид, кальцій оксид. Відповідь підтвердьте рівняннями реакцій.
5. Доповніть схеми реакцій, укажіть назви продуктів реакцій та доберіть коефіцієнти:
а) NaOH + ... -» Na2SO4 + ...; д) ... + SO2 -> Na2SOj + ...;
б) ... + HCI -> AICI3 + ...; е) AI2O3 +...-> AI2(SO4)3;
в) CaO + ... -> Ca(NO3)2 + ...; є) ... + ... -» Fe(NO3)3 + H2O;
г) MgO + ... -> MgCO3; ж) KOH + ... -> K3PO4 + ... .
6. Складіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
a) Mg -> MgO -» MgSO4; 6) Cu -> CuO -» Cu(NOj)2.
7. Порівняйте маси зразків: ортофосфатна кислота кількістю 3 моль та нітратна кислота кількістю 4 моль.
8. Обчисліть кількість речовини атомів Оксигену, що міститься: а) у 0,25 моль сульфітної кислоти; б) 15,6 г силікатної кислоти.
9. Гав, що при розчиненні у воді утворює кислоту, має відносну густину за повітрям 1,17 Складіть формулу цієї кислоти. Як називають її солі? Складіть рівняння добування цього газу з простих речовин.
10. Кальцій карбонат масою 20 г повністю прореагував з хлоридною кислотою. Обчисліть об'єм газу (н. у.), що виділився під час реакції.
11. Розчин натрій силікату масою 61 г з масовою часткою солі 2 % змішали з надлишком хлоридної кислоти. Обчисліть масу утвореного осаду.
12*. Як ви вважаєте, чому сульфатну кислоту називають «матір'ю всіх кислот»? Розкрийте її значення в промисловості.
13*. До яких наслідків, на вашу думку, призводить потрапляння кислот до ґрунтів або водоймищ? У додаткових джерелах інформації знайдіть приклади таких випадків.
Це матеріал з підручника Хімія 8 клас Григорович
Автор: admin от 13-09-2016, 18:05, Переглядів: 9884