§ 28. Класи неорганічних сполук
Пригадайте: які сполуки належать до оксидів та гідратів оксидів (за § 1); як визначити приналежність оксидів до кислотних чи основних; чим відрізняються кислоти та основи;
як визначати ступінь окиснення за формулою сполук та як визначити характерні для елементів ступені окиснення (за § 21, 22);
ступінь окиснення Оксигену переважно -2, Пдрогену +1;
як складати формули сполук за ступенем окиснення елементів (за § 22);
гідрати — це продукти приєднання води до певної сполуки, зокрема, до оксидів.
Класифікація неорганічних сполук
У природі налічується понад п’ять мільйонів неорганічних сполук. Щоб простіше було їх вивчати й досліджувати, речовини розподіляють за різними ознаками на класи.
Клас сполук — це група речовин, що об’єднані за певною спільною ознакою.
У 7 класі ви вже ознайомилися з оксидами та їхніми гідратами (кислотами та основами) (схема 1, с. 6). У 8 класі ви поглибите свої
знання про ці класи, а також ознайомитеся з детальнішою класифікацією неорганічних сполук (схема 3).
Схема 3. Найголовніші класи неорганічних сполук
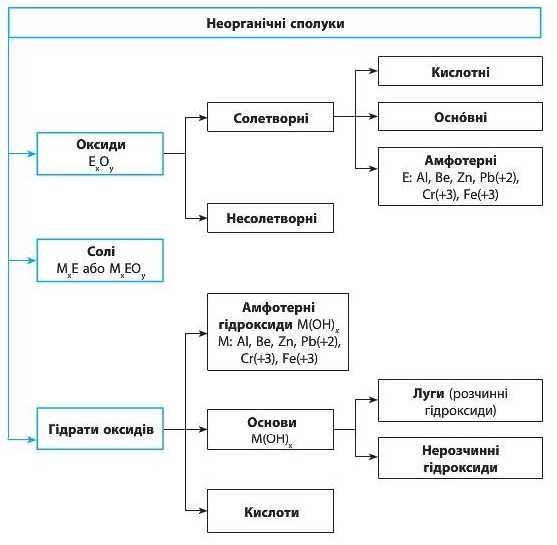
Оксиди
Ви вже знаєте, що оксиди складаються з атомів двох хімічних елементів, один з яких — Оксиген.
Серед оксидів виділяють солетворні та несолетворні оксиди.
Солетворні оксиди — це оксиди, яким відповідають основні або кислотні сполуки. Солетворні оксиди поділяють на такі групи:
• кислотні оксиди — це оксиди, гідрати яких є кислотами. До цієї групи належать більшість оксидів неметалічних елементів та оксиди металічних елементів зі ступенем окиснення, більшим ніж +3, наприклад: SO3, CO.,, NO2, CrO3, Mn2O7 тощо. Кислотні оксиди також називають ангідридами кислот, тобто «безводними кислотами»;
• основні оксиди — це оксиди, гідрати яких є основами. До цієї групи належать оксиди металічних елементів зі ступенем окиснення, не більшим ніж +3, наприклад: CaO, Na2O, MgO, BaO, FeO тощо.
• амфотерні оксиди — це оксиди, що виявляють властивості як кислотних, так і основних оксидів. До них належать: BeO, ZnO, AL2O3, PbO, Cr2O3, Fe2O3 тощо;
Несолетворні оксиди — це оксиди, яким не відповідає ані кислота, ані основа. До них належать: NO, N.,0, CO, SiO.
Формули оксидів — EiO., — складають за ступенем окиснення елементів (див. алгоритм на с. 112).
Назви оксидів складаються:
• для елементів зі сталою валентністю:

наприклад: Na2O — натрій оксид, CaO — кальцій оксид; • для елементів зі змінною валентністю:
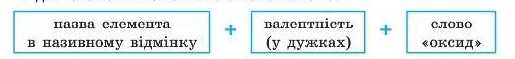
наприклад: CO — карбон(ІІ) оксид, SO., — сульфур(ІУ) оксид.
Назви оксидів неметалічних елементів іноді складають без зазначення валентності, а тільки вказуючи число атомів Оксигену в молекулі грецькими числівниками (моно, ди, три тощо). Наприклад, N0 — нітроген монооксид, CO2 — карбон діоксид, SOj — сульфур триоксид. Іноді співвідношення атомів не є цілими числами, у цьому випадку використовують префікс гемі, що означає «половина». Так, N.,0 — нітроген геміоксид (мається на увазі, що на один атом Нітрогену припадає половина атома Оксигену), N^0, — нітроген геміпентаоксид (на один атом Нітрогену припадає половина від п’яти, тобто два з половиною атоми Оксигену).
Кислоти
Кислоти — це сполуки, що складаються з йонів Гідрогену, які можна замінити йонами металічних елементів, та кислотного залишку
У формулах кислот на першому місці пишуть символ Гідрогену, а інші символи позначають склад кислотного залишку:

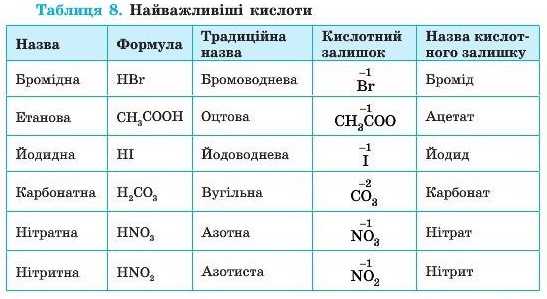
Назви та формули найважливіших кислот, які слід запам’ятати, наведені в таблиці 8.
Крім складу кислотного залишку важливо знати його заряд (це
знадобиться для складання формул солей). У йонів Гідрогену заряд
+1, тому за принципом електронейтральності, заряд кислотного за-
+1 -1
лишку дорівнює числу йонів Гідрогену, але зі знаком «—HCl, +1-2 +1-3
H2SO,, H3PO4.
Зверніть JrBaiyr, що заряд кислотного залишку також дорівнює сумі ступенів окиснення елементів, з яких він складається. Так,
+1 +6-2
у сульфатній кислоті ступені окиснення: H2 S O^. Якщо в кислотному залишку скласти заряди на всіх атомах Сульфуру та Оксигену, то також отримаємо -2.
Закінчення таблиці
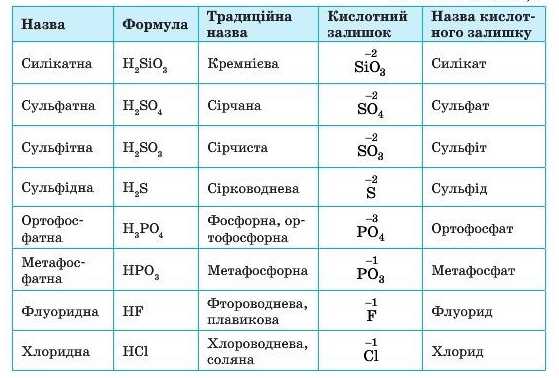
Кислоти класифікують за двома ознаками: за вмістом Оксигену та за основністю.
Основність кислоти — це число йонів Гідрогену, здатних заміщуватися йонами металічних елементів.
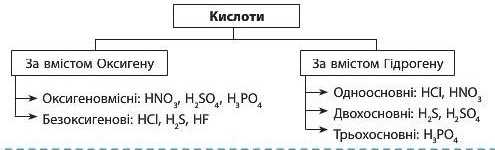
Основність кислоти не завжди збігається із числом атомів Гідрогену в її молекулі. Такі винятки часто трапляються серед органічних кислот, таких як оцтова, лимонна, виноградна тощо. Так, оцтова кислота CH3COOH є одноос-новною. її молекули хоч і містять по чотири атоми Гідрогену, але тільки один атом здатний заміщатися атомом металічного елемента. Серед неорганічних кислот також трапляються такі винятки: фосфітна кислота H3PO3 — є двохосновною, а фосфінова кислота HjPO3 — одноосновна. Серед неорганічних кислот, наведених у таблиці 9, таких винятків немає.
Основи (гідроксиди)
Основи — це сполуки, що складаються з йонів металічного елемента і одного або декількох гідроксид-іонів OH'.
У формулах основ на першому місці пишуть символ металічного елемента, а потім групу ОН:

Як визначити число груп OH (п) у формулах основ? У більшості сполук Оксиген має ступінь окиснення —2, а Гідроген — +1, тому груша OH (гідроксид-іон) має заряд —1: OH1. Знаючи це, легко складати формули гідроксидів: число гідроксид-іонів у складі формульної одиниці дорівнюватиме заряду металічного елемента, наприклад: +1 -і +2 -і
NaOH, Ca(OH)2.
Неорганічні основи ще називають гідроксидами.
Назви основ складаються:
• для елементів зі сталою валентністю:

наприклад: Ca(OH)2 — кальцій гідроксид, NaOH — натрій гідроксид;
* для елементів зі змінною валентністю:

наприклад: Fe(OH)., — ферум(ІІ) гідроксид, Cu(OH)2 — купрум(ІІ) гідроксид.
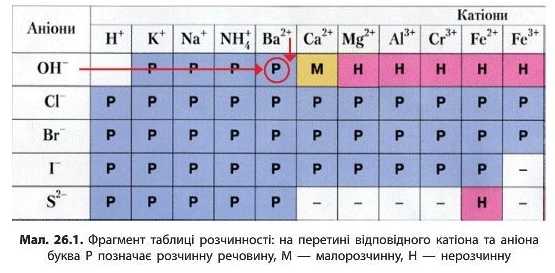
Серед неорганічних основ виділяють дві групи: луги (розчинні гідроксиди) та нерозчинні гідроксиди. Розчинність гідроксидів (як і інших речовин) можна визначити за таблицею розчинності (див. форзац). Наприклад, основа Ba(OH)2, що складається з катіонів Ba12 та аніонів OH1, є розчинною (мал. 28.1, с. 152).
Амфотерні гідроксиди
Амфотерні гідроксиди — це гідроксиди, що виявляють властивості і кислот, і основ.
Амфотерні гідроксиди є гідратами амфотерних оксидів, отже вони утворені тими самими елементи, що й амфотерні оксиди. До амфотерних гідроксидів належать: Be(OH).,, Zn(OH)2, Al(OH)3, Cr(OH)3, Fe(OH)3, Pb(OH)2.
Солі
У побуті сіллю ми зазвичай називаємо лише одну сіль — кухонну, тобто натрій хлорид NaCl. Однак у хімії солями називають цілий клас сполук.
Солі — це сполуки, що складаються з йонів металічних елементів і кислотних залишків.
У формулах солей на першому місці пишуть символ металічного елемента, а потім кислотний залишок:

Назви солей складаються:
• для елементів зі сталою валентністю:

наприклад: FeSO1 — ферум(ІІ) сульфат, CuCl., — купрум(П) хлорид.
наприклад: KySOli — калій сульфіт, CaCOli — кальцій карбонат; • для елементів зі змінною валентністю:

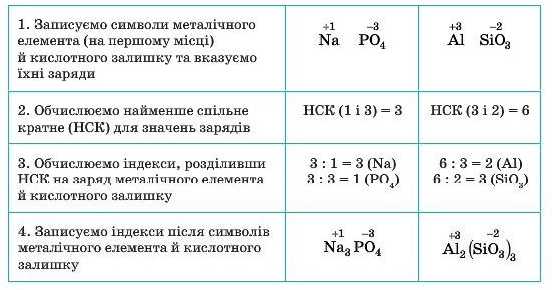
Формули солей складають аналогічно формулам оксидів, зрівнюючи заряди атомів металічного елемента й кислотного залишку.
Алгоритм складання формул солей
(на прикладі натрій ортофосфату та алюміній силікату)
Деякі солі, що широко використовуються в побуті, крім наукових, мають побутові (традиційні) назви. Наприклад, ви вже знаєте, що натрій хлорид NaCl називають кухонною або кам’яною сіллю, натрій карбонат NayCOs — це кальцинована сода, калій карбонат KiCOij — поташ. Традиційні назви найбільш уживаних солей наведено в Додатку 1.
• Чиста кухонна (кам'яна) сіль — безбарвна речовина. А ось «делікатесна», або «царська», сіль має ніжно-рожевий колір та приємний аромат завдяки вмісту мікроскопічних водоростей. В Україні така сіль трапляється на березі солоних Сиваських озер, розташованих на заході Азовського моря. Саме звідси починався шлях українських чумаків.
• Рідко трапляється й синя кам'яна сіль. У ній містяться надлишкові йони Натрію, тобто в кристалі солі йонів Натрію дещо більше, ніж йонів Хлору. Це й зумовлює синє забарвлення. При розчиненні такої солі у воді утворюється звичайний безбарвний розчин.
Лінгвістична задача
Формула кислоти повністю відображена в її назві. Основу назви кислоти становить назва хімічного елемента, що її утворює (елемент Сульфур утворює сульфатну, сульфітну та сульфідну кислоти). Суфіксами позначається ступінь окиснення цього елемента. Якщо елемент, який утворює кислоту, перебуває у вищому ступені окиснення, то в назві кислоти є суфікс am: сульфатна HjSO4 (ступінь окиснення Сульфуру +6 — вищий). Якщо ступінь окиснення елемента менший на 2, то суфікс am замінюється на іт: сульф/тна HjSOj (ступінь окиснення Сульфуру +4). Якщо елемент перебуває в нижчому ступені окиснення, що відповідає безоксигеновим кислотам, то в назві присутній суфікс ід (ид): сульф/дна HjS (ступінь окиснення Сульфуру -2 — нижчий). Установіть відповідність між назвами кислот, наведеними в таблиці 8, та ступенями окиснення хімічних елементів, що їх утворюють.
Висновки
1. Оксиди складаються з атомів двох хімічних елементів, один з яких Оксиген. Назви оксидів складаються з двох слів: перше — назва хімічного елемента, що утворює оксид, друге — слово «оксид». Для елементів зі змінною валентністю в назві оксидів обов'язково вказують валентність елемента.
2. Кислоти складаються з йонів Гідрогену та кислотних залишків. За вмістом Оксигену кислоти поділяють на оксигеновмісні та безоксигенові. За числом атомів Гідрогену — на одноосновні, двохосновні та трьохосновні.
3. Неорганічні основи називають гідроксидами. Вони складаються з йонів металічних елементів та гідроксид-іонів OH . Число гідроксид-іонів у складі гідроксидів дорівнює ступеню окиснення металічного елемента. Серед гідроксидів виділяють луги (розчинні у воді гідроксиди) та нерозчинні гідроксиди. Назви гідроксидів складаються з двох слів: назви металічного елемента та слова «гідроксид».
4. Амфотерні гідроксиди — гідроксиди, що виявляють властивості і кислот, і основ.
5. Солі складаються з йонів металічних елементів та кислотних залишків. Назви солей складаються з двох слів: назви металічного елемента та назви кислотного залишку. Для елементів зі змінною валентністю указують їхню валентність у сполуці.
Контрольні запитання
1. Які речовини називають оксидами? Наведіть приклади оксидів.
2. Запишіть загальну формулу оксидів.
3. Як за хімічною формулою визначити: є оксид кислотним чи основним?
4. Які оксиди належать до несолетворних?
5. Дайте визначення кислотам. Що називають кислотним залишком?
6. За якими ознаками класифікують кислоти? Назвіть групи, на які розподіляють кислоти за різними ознаками, і наведіть відповідні приклади.
7. Які речовини належать до класу основ? Які з них є лугами?
8. Які сполуки належать до солей?
9. Речовини, формули яких KNO3, FeCIj, NajSO4, називають: а) солями; 6) кислотами; в) основами; г) оксидами.
10. Речовини, формули яких HNO3, НСІ, HjSO4, називають: а) солями; 6) кислотами; в) основами; г) оксидами.
11. Речовини, формули яких NOjf FejOj, NajO, називають: а) солями; 6) кислотами; в) основами; г) оксидами.
12. Солі утворені: а) йонами металічних елементів і кислотними залишками; б) йонами металічних елементів і гідроксид-іонами; в) йонами Гідрогену й кислотними залишками.
13. У формулах кислот на першому місці записаний символ: а) Оксигену; б) Гідрогену; в) Сульфуру; г) Карбону.
Завдання для засвоєння матеріалу
1. Визначте ступені окиснення елементів в оксидах і запишіть назви цих
сполук: PjO1., SOj, NajO, MgO, CaO, MnjOj, SnOjf IjOs, CrO3, CujO, CuO.
2. Наведіть приклади несолетворних оксидів. Чому їх так називають?
3. Складіть формули таких оксидів: калій оксид, фосфор(ІІІ) оксид, аргентум(І) оксид, ферум(ІІ) оксид, xnop(IV) оксид, нітроген(\/) оксид, цинк оксид, аурум(ІІІ) оксид, сульфур(УІ) оксид, ванадій(У) оксид.
4. Запишіть формули хлоридної, сульфатної, ортофосфатної, карбонатної, силікатної, сульфідної та нітратної кислот. Підкресліть кислотні залишки та визначте їхній заряд.
5. Наведіть по чотири приклади оксигеновмісних та безоксигенових кислот.
6. Із таблиці 8 випишіть формули кислот: а) оксигеновмісної однооснов-ної; 6) безоксигенової двохосновної; в) оксигеновмісної трьохосновної;
г) безоксигенової одноосновної; д) оксигеновмісної двохосновної.
7. Складіть формули гідроксидів Калію, Магнію, Стануму(ІІ), Цинку, Хрому(ІІІ), Купруму(ІІ), Барію. Підкресліть формули лугів.
8. За таблицею розчинності (див. форзац), випишіть по два приклади формул солей: а) хлоридної кислоти, що нерозчинні у воді; 6) карбонатної кислоти, що розчинні у воді.
9. Назвіть солі: KjSO4, Cr(NO3)3, MgCI2, CuSO4, SnCIj, AgNO3, AIPO4, BaSO3, BaS, BaSO4, NajSiOjf NaBr, MnSO4, AgjS, Mg3(PO4)j. Укажіть над формулами значення заряду металічного елемента та кислотного залишку.
10. Складіть формули солей: кальцій хлорид, магній карбонат, цинк нітрат, алюміній нітрат, калій карбонат, натрій сульфат, кальцій силікат, арген-тум хлорид, магній сульфіт, алюміній сульфід.
Це матеріал з підручника Хімія 8 клас Григорович
Автор: admin от 13-09-2016, 18:01, Переглядів: 7262