§ 24. Кількість речовини. Моль — одиниця кількості речовини. Число Авогадро
Пригадайте: усі речовини складаються з дуже маленьких частинок; найменші з них — атоми, для зручності ми їх уявляємо у вигляді кульок; атоми можуть об'єднуватися один з одним і утворювати молекули; кожна речовина характеризується тільки їй притаманними молекулами.
Кількість речовини — фізична величина
Майже все, що людина бачить навколо себе, вона намагається описати кількісними характеристиками. Так, коли ми витрачаємо воду', ми обчислюємо її об’єм: скільки літрів (або кубометрів) її витекло з крану. Купуючи цукерки, ми вказуємо продавцеві їхню масу: скільки грамів треба зважити. Але в певних випадках знання маси або об’єму буде недостатнім. Наприклад, нам потрібно купити стільки яблук, щоб вистачило на всіх учнів у школі. Досить складно на ринку перераховувати тисячу чи дві тисячі яблук. Значно простішим буде порахувати число ящиків яблук (за умови, що ми знаємо, скільки яблук міститься в одному ящику). Тобто в даному випадку ми рахуємо не окремі частинки, а число груп чи порцій частинок (мал. 24.1, с. 126).
Для розуміння хімічних явищ і процесів не завжди потрібно знати масу чи об’єм речовини. Часто для визначення кількості речовини набагато важливіше знати число атомів чи молекул, наприклад при складанні рівнянь хімічних реакцій.
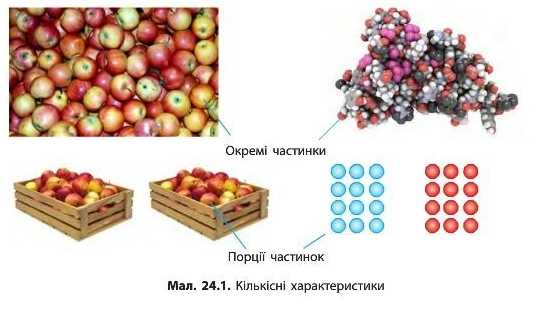
Для визначення числа частинок використовують спеціальну фізичну величину — кількість речовини. Її позначають латинською буквою п.
Вона показує, скільки частинок (структурних одиниць) даної речовини МІСТИТЬСЯ В TOMJ' чи іншому зразку.
Для речовин молекулярної будови такими частинками є молекули, а для речовин немолекулярної будови такими частинками можуть бути атоми або йони.
Кількість речовини — фізична величина, що показує число структурних одиниць речовини (d і омів, молекул, йонів ющо).
Моль — одиниця вимірювання кількості речовини
Атоми і молекули дуже малі, тому не дивно, що їх число в навколишньому світі величезне. Навіть у самому маленькому кристалі цукру число молекул перевищує мільярд мільярдів. Тому практично неможливо перераховувати окремі молекули. Для вимірювання кількості речовини використовують спеціальну одиницю — моль.
1 моль — це така кількість речовини, що містить 6,022 · IOb структурних одиниць цієї речовини (атомів, молекул, йонів тощо).

До кількості речовини слід ставитися як до звичайного числа, що дозволяє виразити число атомів або молекул у певній порції речовини (мал. 24.2). У тому, що один моль речовини містить таке «екзотичне» число частинок, не має нічого незвичайного. Подібні числа (або порції) нам трапляються досить часто, і використовуємо ми їх для вимірювання маси, об’єму, часу і навіть грошей. Більшість з них є досить простими числами. Наприклад, одна тонна — це одна тисяча кілограмів, один кубічний метр — це одна тисяча літрів, одна година — це 60 хвилин, одна гривня — це сто копійок. Існують також величини вимірювання, що не кратні десяти: одна доба — це 24 години, одна дюжина — це 12 штук, один карат — це 0,4 грама, а один світловий рік — це майже 9,5 · IO12 кілометрів.
У кожної речовини є свої власні структурні одиниці. Наприклад, вугілля складається з атомів Карбону, а сірка — з молекул Sb. Тому зразки різних речовин кількістю речовини 1 моль мають різні маси та об’єми (мал. 24.3).
Число Авогадро
Число 6,022 · IO2s називають числом Авогадро на честь італійського вченого Амедео Авогадро. Чому саме таке число було обране для визначення моля речовини? Справа в тому, що стільки атомів міститься у зразку вуглецю масою 12 г, що в сучасній науці використовують як стандарт для визначення атомної одиниці маси. Ураховуючи це, можна дати ще одне визначення моля:
Італійський фізик і хімік. Народився вТурині в родині службовця судового відомства. Здобув юридичну освіту, після чого став доктором церковного законознавства. У 24 роки почав самостійно вивчати природничі науки. Із Ί809 р. викладав у Туринському університеті на посаді професора вищої фізики. Із 1850 р. директор відділення фізики й математики Туринської академії наук. Увів у науку поняття «молекула» і «молекулярна вага». На основі відкритого ним закону розробив метод визначення молекулярних і атомних мас. Першим встановив, що формула води HjO, а не НО, як вважали раніше. Установив склад багатьох речовин — водню, кисню, азоту, амоніаку, оксидів Нітрогену, Хлору, Фосфору тощо. Уперше правильно визначив атомну масу багатьох елементів. Заклав основи атомно-молекулярної теорії. Однак його праці було визнано лише після його смерті у 1860 р. на Міжнародному конгресі хіміків у Карлсруе.

1 моль — це така кількість речовини, у якій число частинок (атомів чи молекул) дорівнює числу атомів Карбону ,?С, що міститься в зразку вуглецю масою 12 г.
Числу Авогадро чисельно дорівнює стала Авогадро ΝΛ. Ця стала, на відміну' від числа Авогадро, виражається в одиницях, ділених на моль (1/моль або моль-1):
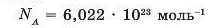
Для більшості розрахунків число Авогадро округляють до б · IO-*'1.
Відомо, що один атом Карбону нукліду ,?С має масу 1,9993 · 10 23 г. Отже, у 12 грамах такого вуглецю число атомів Карбону дорівнює:
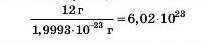
Із курсу хімії 7 класу вам відомо, що одна атомна одиниця маси дорівнює 1,66 · 10 24 г. Добуток атомної одиниці маси й числа Авогадро дорівнює 1 г:
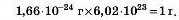
Отже, визначення моля безпосередньо пов'язане з визначенням одиниці маси атомів і молекул, а число Авогадро є коефіцієнтом пропорційності між масою атомів та їхньою відносною атомною масою.
Розв'язання задач з використанням кількості речовини
Знаючи сталу Авогадро, можна будь-яку кількість речовини виразити в молях. Якщо речовина містить N молекул (або структурних одиниць), то кількість речовини дорівнює:
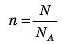
Навпаки, знаючи кількість речовини в молях, можна обчислити число частинок:
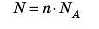
Задача 1. У кімнаті міститься 2,77 * IO26 молекул кисню. Визначте кількість речовини кисню.
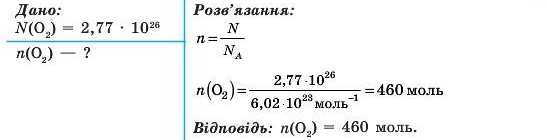
Задача 2. Визначте число атомів Оксигену й Гідрогену, що містяться в 5 моль води.

Задача 3. У склянці міститься близько 11 моль молекул води. Визначте число молекул у склянці.
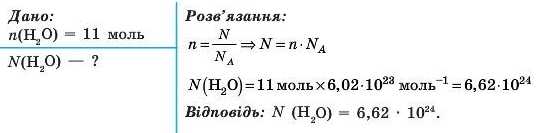
Лінгвістично задачо
Слова «моль» і «молекула» мають спільний корінь і походять від латинських слів.
Слово «молекула» було трансформовано зі словосполучення молес-корпускула або
мас-корпускула. Як ви вважаєте, що латиною означає слово «молес»?
• Зробити висновок про те, наскільки величезне чисельне значення сталої Авогадро, можна за таким порівнянням: площа поверхні нашої планети дорівнює 510 млн км2. Якщо рівномірно розсипати по всій поверхні 6,02 · IO23 піщинок діаметром лише 1 мм, то вони утворять шар піску завтовшки понад один метр.
• У наш час добуто силіцій із чистотою 99,9999999 %. Це означає, що серед одного мільярда атомів Силіцію міститься лише один атом іншого елемента.
• В Америці вчені святкують день числа Авогадро. Святкування відбувається о 6 годині 02 хвилини ранку 23 жовтня до 6 години 02 хвилин наступного дня.
Висновки
1. Кількість речовини — одна з фізичних величин, що дозволяє вимірювати кількісні характеристики речовини. Вона показує число структурних одиниць речовини в певному зразку.
2. Кількість речовини позначається буквою п; одиниця вимірювання — моль. У речовині кількістю 1 моль міститься 6,02 · IO23 структурних одиниць цієї речовини (атомів, молекул, йонів тощо).
3. Число 6,02 · IOj3 називають числом Авогадро. Воно дорівнює числу атомів Карбону, що міститься в зразку вуглецю масою 12 г. Стала Авогадро позначається символом N. і дорівнює 6,02 · IOi3 моль-1.
Контрольні запитання
1. Дайте визначення понять «кількість речовини» та «моль».
2. Яку розмірність має стала Авогадро? Чому дорівнює її значення?
3. Запропонуйте, у якій спосіб можна наочно продемонструвати, наскільки велике число Авогадро.
4. Наведіть формулу для обчислення кількості речовини за відомим числом частинок.
Завдання для засвоєння матеріалу
1. У ложці води міститься близько 0,5 моль речовини. Обчисліть число молекул води в ложці.
2. У склянку вміщується близько 1,5 моль цукру. Обчисліть число молекул цукру в склянці.
3. У повітряній кулі міститься близько 0,9 · 10“ молекул азоту. Обчисліть кількість речовини азоту (у молях).
4. Яке число атомів Оксигену (у молях) міститься у вуглекислому газі CO2 кількістю: а) 0,5 моль; б) 2 моль?
5. Обчисліть кількість речовини озону O3, якщо відомо, що число атомів Оксигену в ньому становить: а) 3 · IOji; б) 0,6 · I О’9; в) 3 моль;
г) 0,18 моль.
6. Визначте кількість речовини атомів кожного хімічного елемента, що міститься в 1 моль наведених сполук: a) Cl2; 6) H2SO4; в) H3PO1; г) Fe2O3; Д) Ca(OH)2.
Це матеріал з підручника Хімія 8 клас Григорович
Автор: admin от 13-09-2016, 18:00, Переглядів: 8406