§ 17. Природа хімічного зв'язку
Пригадайте визначення електронних конфігурацій атомів {за § 13);
причину стійкості атомів інертних елементів (за § 15).
Електронна природа зв'язку
Майже двісті років тому вченими було введено поняття про валентність як здатність атомів сполучатися з іншими атомами. Наприклад, атоми Гідрогену завжди одновалентні, а Оксигену — двовалентні. Ґрунтуючись на цих даних, почали зображувати структурні формули молекул у такий спосіб:
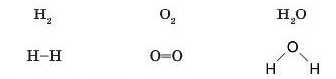
У цих формулах рисочками позначені хімічні зв’язки, що існують між атомами. Але що є хімічним зв’язком? Тільки після відкриття електрона англійським фізиком Дж. Томсоном у 1897 р. було висловлене припущення, що хімічні зв’язки мііють електронну природу' й утворюються завдяки зміщенню або перенесенню електронів від одного атома до іншого. Пізніше виявилося, що ця гіпотеза бу'ла правильною.
Атом, як ви вже знаєте, складається з позитивно зарядженого ядра і негативно заряджених електронів. Найпростіший атом —
атом Гідрогену — містить лише один електрон, який перебуває на першому енергетичному рівні. При зближенні двох атомів Гідрогену ядро одного з них притягує електрон іншого атома і навпаки. Між атомами виникає взаємодія, і відстань між ними зменшується доти, поки взаємне притягання не врівноважиться відштовхуванням двох позитивних ядер. У молекулі водню, що утворилася, електронна густина (імовірне місцезнаходження електронів) у просторі між ядрами виявляється підвищеною завдяки перекриванню орбіталей атомів Гідрогену (мал. 17.1).
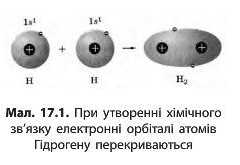
Хімічний зв'язок — це взаємодія атомів, що зумовлює стійкість багатоатомних частинок (молекул, йонів, кристалів).
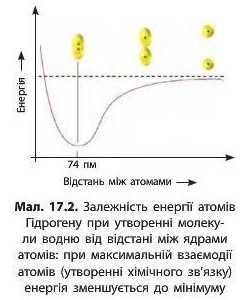
При утворенні хімічного зв’язку між атомами енергія молекули нижча за енергію окремих атомів (мал. 17.2), а прагнення до зменшення енергії — це діюча сила будь-яких взаємодій. Зменшення енергії молекули в порівнянні з енергією окремих атомів причина утворення хімічного зв’язку.
Умови виникнення ХІМІЧНОГО зв'язку
Не всі атоми можуть взаємодіяти між собою. Трапляється так, що при зближенні деяких атомів і перекриванні їхніх електронних орбіталей молекула не утворюється. Наприклад, якщо два атоми Гелію наближаються один до одного, то молекула He2 утворитися не може.
Умови виникнення хімічного зв’язку визначив американський хімік Дж. Льюїс, який у 1916 р. запропонував електронну' теорію хімічного зв’язку. Ця теорія ґрунтується на уявленні про те, що електронні
Американський фізико-хімік, працював у галузі електрохімії, термодинаміки і теоретичної хімії. Народився в м. Уеймут близько Бостона. У 14 років вступив до університету Небраска, а через три роки перевівся до Гарварду. З 26 років викладав у Гарварді, Кембриджі. У 39 років став деканом хімічного факультету в університеті Берклі, який під його керівництвом став одним з найкращих факультетів країни. У 1916 р. Лью-їс висунув ідею, що хімічний зв'язок утворюється завдяки спільній парі електронів, а також що зовнішній електронний шар містить вісім електронів (хоча термін «октет» ніколи не вживав). У 1932 р. сформулював теорію кислот і основ (теорію Льюїса). Уперше виділив чисту «важку воду». Льюїса називають одним з найви-датніших фізико-хіміків США. Серед його учнів 289 докторів наук і 20 лауреатів Нобелівської премії, хоча йому самому здобути Нобелівську премію так і не судилося.

оболонки атомів інертних елементів відрізняються особливою стійкістю, чим і пояснюється їхня хімічна інертність. Атоми всіх інших елементів при утворенні хімічного зв’язку прагнуть змінити електронну оболонку до конфігурації найближчого інертного елемента, віддаючи або приєднуючи електрони. Тільки в такому' випадку утворюються стійкі молекули. Це твердження називають правилом октету Льюїса (від латинського слова окто — вісім), оскільки атоми всіх інертних елементів (крім Гелію) містять на зовнішньому рівні по вісім електронів.
Отже зрозуміло, чому молекула H2 стійка, а молекули Не., не існує. Це пов’язано з тим, що атому' Гідрогену до завершення зо-рпіптпього рівпя браісус одного електрона. При утворенні молекули H., електрони двох атомів об’єднуються і електронна конфігу'рація кожного атома доповнюється до конфігурації атома Гелію. А в атомі Гелію зовнішній енергетичний рівень вже заповнений, тож йому просто не потрібні «зайві» електрони.
Типи хімічного зв'язку
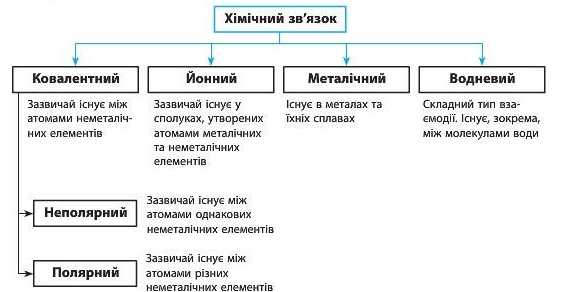
У речовинах розрізняють декілька типів хімічного зв’язку'. Усі вони утворюються завдяки усуспільненню або передачі електронів, але між типами зв’язку' існують су'ттєві відмінності. Затежно від виду' атомів, що сполучаються, можуть утворюватися різні типи зв’язку', але можна стверджувати, що в усіх металах існує металічний зв’язок.
У 8 класі ви ознайомитеся з ковалентним та йонним зв’язками, а інші вивчатимете у старших класах.
Схема 2. Типи хімічного зв’язку
Перша стаття, опублікована Льюїсом у 1916 р. з теорії хімічного зв’язку, містила на той час революційні ідеї, а сьогодні це вивчають у шкільному курсі хімії. Але сучасники не змогли оцінити роботу Льюїса. Через три роки на неї звернув увагу відомий фізик Ленгмюр, який доповнив уявлення Льюїса про ковалентний і йонний зв'язки. Авторитет Ленгмюра на той час був настільки великий, що йому мимоволі була приписана слава створення теорії хімічного зв'язку. Сьогодні справедливість відновлена, і Льюїс вважається засисюїіиком цісї теорії.
Висновки
1. Хімічний зв'язок має електронну природу і реалізується завдяки притягуванню електронів одного атома до ядра іншого атома.
2. Хімічний зв'язок утворюють ті атоми, електронна конфігурація яких відрізняється від конфігурації атомів інертних елементів. При утворенні атоми усуспільнюють або перерозподіляють електрони, щоб набути електронної конфігурації атомів найближчого інертного елемента.
Контрольні запитання
1. Чому число відомих молекул набагато перевищує число існуючих хімічних елементів?
2. За участю яких частинок утворюється хімічний зв'язок: а) протонів; 6) електронів; в) нейтронів?
3. Які взаємодії існують у молекулі водню? Як вони змінюються залежно від відстані між ядрами атомів?
4. Дайте визначення хімічного зв'язку. Завдяки чому він утворюється?
5. Чому одні атоми взаємодіють один з одним, а інші — ні?
6. Які існують типи хімічного зв'язку?
7. За яким правилом можна визначити атоми, що здатні утворити хімічний зв’язок?
Завдання для засвоєння матеріалу
1. Скільки електронів не вистачає до октету атомам Нітрогену, Хлору, Сульфуру, Карбону, Флуору, Оксигену?
2. До електронної конфігурації якого інертного елемента прагнуть атоми Літію, Оксигену, Кальцію, Алюмінію, Хлору? Атоми цих елементів будуть віддавати чи приєднувати електрони при утворенні хімічних зв'язків?
3. Визначте, скільки електронів можуть віддати атоми Літію, Магнію, Калію, Алюмінію, Фосфору, Хлору.
Це матеріал з підручника Хімія 8 клас Григорович
Автор: admin от 13-09-2016, 17:56, Переглядів: 5062