§ 44. Закон фарадея для електролізу
Процес розкладання речовини електричним струмом, який супроводжується виділенням на електродах складових речовин, які входять до складу електроліту, називається електролізом.
Електрохімічний еквівалент. Дослідження Фарадея показали, що електрохімічний еквівалент k характеризує кожну речовину, він різний для різних речовин.
Перший закон електролізу Фарадея. З проходженням струму крізь електроліт позитивні йони рухаються до катода, де отримають недостатні у них електрони, стають нейтральними і осідають на відповідному електроді.
Негативні йони рухаються до анода, віддаючи йому зайві електрони, стають нейтральними та осідають. Иони можуть осідати на електрод або випадати в осад, або виділятися в атмосферу.
Процес розкладання речовини електричним струмом, який супроводжується виділенням на електродах складових речовин, які входять до складу електроліту, називається електролізом.
Продовжимо дослід (рис. ). Будемо пропускати електричний струм різної сили і протягом різного часу, зважуючи вугільний електрод після кожної частини досліду з тим, щоб визначити масу міді, яка виділилася. Проаналізувавши результати дослідів, можна зробити висновок, що маса міді, що виділилася, залежить і від сили струму, і від часу проходження струму через електроліт.
У 1834 р. дослідним шляхом англійський фізик Майкл Фарадей встановив такий закон:
Маса речовини, що виділяється на електроді, прямо пропорційна електричному заряду, що пройшов крізь
електроліт.

Це перший закон електролізу, або перший закон Фарадея. Його можна записати так:
т = kq = kit (I)
де т - маса речовини, що виділилася на електроді, q - заряд, що пройшов крізь електроліт, І - сила струму, t - час проходження струму крізь електроліт, k -коефіцієнт пропорційності, який називають електрохімічним еквівалентом.
ПОГЛИБТЕ СВОЇ ЗНАННЯ
* Другий закон Фарадея. Як видно із таблиці, електрохімічні еквіваленти різних речовин дуже істотно відрізняються один від одного.
Електрохімічні еквіваленти, мг/Кл
Таблиця.
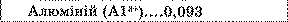 |
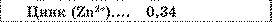 |
 |
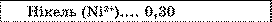 |
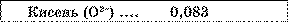 |
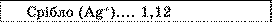 |
 |
 |
Постає питання: від яких же властивостей речовини залежить значення електрохімічного еквівалента?
Відповідь на це питання дає встановлений дослідним шляхом другий закон Фарадея:
Електрохімічні еквіваленти різних речовин прямо пропорційні їх молярній масі та обернено пропорційні їх валентності.
Другий закон Фарадея можна записати у вигляді формули

де k - електрохімічний еквівалент, M - молярна маса речовини, що виділяється на електроді, п - валентність речовини.

Фізичне знання в техніці
Застосування електролізу у промисловості й техніці
Відомо, що явище електролізу покладено в основу принципу дії кислотних і лужних акумуляторів.
За допомоги електролізу з солей і оксидів дістають багато хімічно чистих металів, наприклад алюміній, мідь, нікель. Оскільки електролітичний спосіб дає можливість отримувати речовини з незначною кількістю домішок, то його використовують для утворення надчистих матеріалів.
Для захисту виробів від окислення, для підвищення їх міцності або просто для надання їм привабливого вигляду часто наносять на них тонкий шар таких металів, як хром, нікель, срібло, золото. Для цього також використовують електроліз. Електролітичний спосіб покриття виробів тонким шаром металу називається гальваностегією (від імені італійського вченого Гальвані і грецького τεγη - покриття).
Якщо пропускати струм крізь електроліттривалий час, то на виробі може утворитися шар металу такої товщини, що його можна відокремити від виробу, збе-рігши форму, і отримати точну копію виробу. Електролітичне отримання точних копій різних виробів називається гальванопластикою. За допомогою гальванопластики дістають копії предметів складної форми, зокрема копії скульптур та інших витворів мистецтва. Метод гальванічного покриття і отримання точних копій предметів розроблено в 1838 р. російським ученим Б.С. Якобі.
Особливо важливим є електролітичне отримання алюмінію з розплаву роз-
чину глинозему в кріоліті. Електроліз проводять при 900 0C в електролітичній залізній печі, викладеній всередині пресованою вугільною масою, що є катодом. Зверху розміщені вугільні стержні - аноди. Алюміній, який виділяється на катоді знаходиться в розплавленому стані.
Отож, ми ознайомились з найбільш поширеними способами застосування електролізу у промисловості та техніці.
Розширте науковий кругозір
Чи існують тверді електроліти? Так. Прикладом твердого електроліту може бути усім відоме скло. Наявні у склі іони натрію за низьких температур переміщуються слабо і скло є ізолятором. Якщо ж нагріти скло до температури 300-400 °С, то іони натрію мають можливість переміщуватися під дією сил електричного поля і скло стає провідником електричного струму.
Подумайте і дайте відповідь
1. Що таке електроліт?
2. Що таке електроліз?
3. Від чого залежить маса речовини, що виділяється на електроді під час електролізу?
4. Як формулюється перший закон електролізу?
5. Який фізичний зміст електрохімічного еквівалента?
6. Як у промисловості та в техніці використовується явище електролізу?
7. Що таке гальваностегія? Гальванопластика?
Розв’яжіть задачі та оцініть результати
Вправа 44.
1. Чому дорівнює маса міді, що виділяється з розчину за 6 год при силі струму 2 А?
2. Яка потрібна сила струму, щоб нанести на спортивну нагороду - кубок 20,12 г срібла за 10 год?
Це матеріал з підручника Фізика 8 клас Шут
Автор: evg от 12-08-2016, 13:47, Переглядів: 10412