§ 11. Тепловий баланс. Рівняння теплового балансу.
Тепловий баланс -від французького слова balance - терези.
У загальному випадку, коли між тілами відбувається теплообмін, внутрішня енергія всіх тіл, які нагріваються, зростає настільки, наскільки зменшується внутрішня енергія тіл, що охолоджується.
Рівняння теплового балансу є проявом закону збереження енергії, сформульованого з урахуванням особливої форми передачі енергії
► 1. Рівняння теплового балансу як прояв закону збереження і перетворення енергії. Для практичних цілей дуже часто буває необхідно досліджувати стани різних тіл після встановлення між ними стану теплової рівноваги в теплових процесах. Такий стан називають ще тепловим балансом. Тепловий баланс - це розподіл кількості теплоти (внутрішньої енергії) між тілами, які брали участь у тепловому процесі.
Проаналізуємо результати обчислення кількості теплоти, одержані при розв’язуванні задачі у пункті 5 попереднього параграфу (§ 10).
Як видно, кількість теплоти Q1, яку отримала холодна вода і кількість теплоти Q2, яку віддав окріп, однакові. Це не випадковий результат. Він є проявом загального закону збереження енергії у будь-якому природному процесі.
Закон збереження енергії у теплових процесах можна сформулювати таким чином:
кількість теплоти, яка втрачається одними тілами в процесі теплообміну, дорівнює кількості теплоти, яку набувають інші тіла, що беруть участь у даному процесі.
Цей висновок можна виразити математично:
Qi +Q2 +Q3 + ··· = Qi+ + Ql +Qe + ···
де індекс «-» означає кількість теплоти, яка віддається тілом, а індекс «+» вказує на те, що цю кількість теплоти тіло отримує.
у вигляді теплообміну. Цей закон є фундаментальним законом фізики. Він встановлений у результаті Ґрунтовних експериментальних і теоретичних досліджень у галузі фі-
• ш ···
зики і хімії.
Наведену рівність називають рівнянням теплового балансу.
Складання рівняння теплового балансу покладено в основу розрахунку процесів теплообміну при розв’язуванні багатьох задач та виконанні експериментально-дослідницьких завдань. Щоб виконання таких завдань було успішним, бажано дотримуватися такої послідовності дій:
1. Встановити, які тіла беруть участь у теплообміні.
2. Визначити, якої температури набувають тіла після встановлення стану теплової рівноваги. Якщо за умовою задачі вона не задана, слід позначити и літерою tі переходити до наступної дії.
3. З’ясувати, які з тіл віддають теплоту, а які її отримують. Скласти рівняння теплового балансу в загальному вигляді.
4. Записати формулу кількості теплоти для кожного з тіл, які беруть участь у процесі теплообміну.
5. Здійснити підстановку отриманих формул кількості теплоти для кожного з тіл у рівняння теплового балансу.
6. Розв’язати отримане рівняння теплового балансу відносно шуканої величини і перевірити її одиницю. Зробити аналіз отриманого результату на предмет його достовірності.
► 2. Застосування рівняння теплового балансу для розв’язування задач.
Задача. Обчислити, якою стане температура суміші в стані теплової рівноваги, який встановиться після змішування 200 г окропу при IOO0C і 100 г води при температурі 18°С.

► 3. Калориметр. Рівняння теплового балансу передбачає врахування у теплообмінному процесі змін теплових станів всіх тіл, що беруть у ньому участь. Зрозуміло, що на практиці це зробити важко, оскільки завжди мають місце втрати теплоти у навколишнє середовище. Такі теплові втрати намагаються значно зменшити. Для цього використовують спеціальні прилади (закриті посуди-
ни), у яких розміщують тіла, що беруть участь у теплообмінному процесі. Одним з таких приладів є калориметр (рис.60).

Калориметр — від латинського слова calor — тепло і грецького слова metreo — вимірюю.
Найпростіший калориметр складається з тонкостінного алюмінієвого циліндра 1 і зовнішньої пластмасової посудини 2 з кришкою 3 (рис. 60, а). Завдяки теплоізоляційним прокладкам 4 і повітряного прошарку 5, а також наявності подвійних стінок, обмін теплотою між зовнішнім середовищем і середовищем всередині калориметра значно зменшується. Температуру у стані стану теплової рівноваги між рідиною і досліджуваним тілом 6 всередині калориметра вимірюють термометром 7. Калориметр комплектується також мішалкою для перемішування речовин.
При дослідженні стану теплової рівноваги речовин в калориметрі, можна нехтувати втратами теплоти в навколишнє середовище і використовувати рівняння теплового балансу. Якщо дослід чітко спланувати, швидко виконати та вчасно зафіксувати встановлення стану теплової рівноваги всередині калориметра, результат досліду буде достовірним. Проте на досліді не можна одержати рівності між відданою та одержаною кількостями теплоти.
Калориметри використовують для дослідження теплових процесів у різних природничих науках: фізики, хімії, біології, екології. Розділ фізики, у якому розглядаються методи калориметричних вимірювань, називається калориметрією.
Подумайте і дайте відповідь
1. Що називається тепловим балансом?
2. Проявом якого фундаментального фізичного закону є рівняння теплового балансу?
3. У яких дослідженнях необхідно використовувати рівняння теплового балансу?
4. Запишіть рівняння теплового балансу.
5. Якої послідовності дій слід дотримуватися при застосуванні рівняння теплового балансу до розрахунку процесу теплообміну між тілами?
6. Для чого використовують калориметр? Опишіть його будову.
Розв’яжіть задачі та оцініть результати
Вправа 11.
1. Два учні мають одержали завдання визначити теплоємність твердого тіла. Один учень узяв зібраний калориметр і налив у нього води при кімнатній температурі. Другий учень скористався лише внутрішньою посудиною калориметра і налив туди води такої самої маси. Обидва учні опустили у воду однакові тіла, нагріті до однакової температури. Хто точніше виконав завдання? Чому?
2. Яка питома теплоємність речовини, якщо для нагрівання 10 кг цієї речовини на 20 0C слід витратити 184 кДж енергії? Скористайтеся таблицею питомих теплоємностей (таблиця 1) і встановіть, що це за речовина.
3. На скільки градусів підвищиться температура алюмінієвої ложки масою ЗО г, якщо на її нагрівання витратиться кількість теплоти, виділена при охолодженні 40 г води від 70°С до 100C?
ЛАБОРАТОРНА РОБОТА № 1
Вивчення теплового балансу за умов змішування води різної температури
Мета роботи:
Експериментально дослідити умови, за яких справджується рівняння теплового балансу; навчитися застосовувати рівняння теплового балансу при дослідженні реального теплообмінного процесу.
Прилади і матеріали: 1) посудина з холодною водою (бажано кімнатної температури); 2) посудина з гарячою водою; 3) мірний циліндр (мензурка); 4) калориметр; 5) термометр; 6) секундомір. Для додаткового завдання: важільні терези.
Порядок виконання роботи
1. Ознайомтеся з будовою калориметра. Уважно прочитайте правила користування цим приладом. Чітко сплануйте експериментаторські дії. Для цього ще раз прочитайте за підручником «Фізика 7» (§ 10) рубрику «Це треба знати» (як виконувати спостереження, досліди та інші експериментальні завдання).
2. Налийте в мензурку холодну воду, виміряйте її об’єм та обчисліть масу Ttt1.
3. Перелийте холодну воду в калориметр та виміряйте її температуру tv
4. Виміряйте температуру гарячої води t2.
5. Перелийте гарячу воду в калориметр і одночасно з цим увімкніть секундомір. Обережно перемішайте термометром одержану суміш та виміряйте її температуру t. після встановлення стану теплової рівноваги. За допомогою секундоміра зафіксуйте час встановлення теплової рівноваги суміші води.

6. Після остигання перелийте воду з калориметра у мензурку, виміряйте її загальний об’єм V та обчисліть загальну масу води за
10. Розрахуйте кількість теплоти, яку віддала гаряча вода, за формулою: Q2 = cm2(t2 - t).
11. Результати обчислень Q1- і Q2 запишіть у таблицю 2.
Результати вимірювань і обчислень
(до лабораторної роботи №1)
Таблиця 2
 |
 |
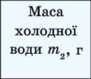 |
 |
 |
 |
11. Порівняйте одержані значення Q1' і Q2. Запишіть рівняння теплового балансу для досліджуваного процесу.
12. За даними досліду побудуйте графіки теплових процесів: 1) нагрівання холодної води; 2) охолодження гарячої води.
13. Зробіть висновки щодо:
- теплових втрат, які необхідно врахувати у досліджуваному процесі;
- експериментаторських умінь, яких ви набули при виконанні лабораторної роботи.
Контрольні запитання
1. Пояснять, чи можна у даному досліді одержати строгу рівність між кількістю теплоти, яку отримала холодна вода, та кількістю теплоти, що віддала гаряча вода?
2. Чому, на вашу думку, загальний об’єм води після змішування рекомендується вимірювати після остигання води?
Додаткове завдання
За результатами виконаного досліду обчисліть кількість теплоти, витраченої на нагрівання калориметра. Масу калориметра визначте за допомогою важільних терезів. Питома теплоємність алю-
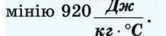
Перевірте, чи задовольняє одержане значення рівнянню теплового балансу.
ЛАБОРАТОРНА РОБОТА № 2 Визначення питомої теплоємності речовини
Мета роботи
Визначити питому теплоємність речовини твердого тіла способом змішування; порівняти одержаний результат з табличними значеннями питомих теплоємностей речовин і назвати досліджувану речовину.
Прилади і матеріали: 1) металеве тіло; 2) міцна нитка; 3) калориметр; 4) посудина з холодною водою; 5) посудина з гарячою водою; 6) мензурка; 7) терези з набором гир; 8) термометр.
Теоретичні відомості
Питому теплоємність твердого тіла с можна визначити способом змішування. Суть цього методу полягає в тому, що досліджуване тіло, нагріте до певної температури в нагрівнику, швидко опускають в холодну воду. Між тілами відбувається теплообмін і встановлюється стан теплової рівноваги. При цьому кількість теплоти, яку віддає досліджуване тіло внаслідок охолодження, дорівнює кількості теплоти, яку одержують оточуючі тіла.
Складемо рівняння теплового балансу для описаного процесу.
Кількість теплоти Q9 яку віддає тіло при остиганні:
Q = cm (t-t0)9
де с - шукана теплоємність;
т - маса досліджуваного тіла;
tQ - початкова температура тіла;
t - кінцева температура тіла.
Кількість теплоти Q1, яку одержує вода:
Q = C1TTi1 (t-tj,
де C1 - питома теплоємність води; т1 - маса води;
- початкова температура води; t - кінцева температура води.
Кількість теплоти Q2, яку одержує калориметр:
Q2 = С2т2 (ί_ίΐ)’
де C2 - теплоємність алюмінію;
т2 - маса внутрішньої посудини калориметра;
- початкова температура калориметра (вона дорівнює температурі холодної води, яка знаходиться в калориметрі);
t - кінцева температура калориметра (вона дорівнює кінцевій температурі води калориметрі).
Тоді Q = Q1+ Q2 або
cm(t - f0) = ClTnJit - tj + C2Tn2(t - tj)
З рівняння теплового балансу одержимо:
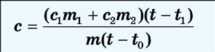
Порядок виконання роботи
1. Виміряйте масу досліджуваного металевого тіла m за допомогою терезів.
2. Закріпіть металеве тіло на нитці і опустіть його в посудину з гарячою водою.
3. Виміряйте масу внутрішньої посудини калориметра т2 за допомогою терезів.
4. Налийте у мензурку холодну воду та визначте її об’єм V1 і масу Ttt1 (маса холодної води має бути такою, щоб після п переливання в калориметр металеве тіло могло повністю зануритись у
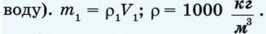
5. Перелийте холодну воду в калориметр і виміряйте п температуру tv
6. Виміряйте температуру гарячої води в посудині, де знаходиться досліджуване тіло. Це буде початкова температура тіла tQ.
7. Швидко опустіть в калориметр з холодною водою металеве тіло, що нагріте в гарячій воді.
8. Виміряйте температуру води в калориметрі після того, як встановиться стан теплової рівноваги між водою та зануреним у неї тілом. Це буде кінцева температура тіла t.
9. Результати вимірювань і обчислень запишіть у таблицю 3.
10. Визначте питому теплоємність металевого тіла за формулою
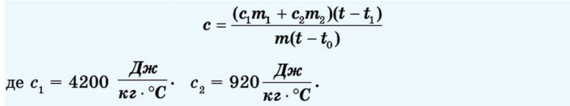
11. Результати вимірювань і обчислень запишіть у таблицю 3.
Таблиця З
 |
 |
 |
 |
 |
 |
 |
 |
12. Порівняйте одержаний результат з табличними значеннями питомих теплоємностей речовин і назвіть речовину, з якої виготовлене досліджуване металеве тіло.
13. Зробіть висновки щодо:
- похибок вимірювання, які найбільш суттєво вплинули на одержане значення питомої теплоємності, та можливостей їх зменшення;
- експериментаторських умінь і навичок, яких ви набули під час виконання роботи.
Контрольні запитання
1. Які теплові втрати не враховані у даному методі визначення питомої теплоємності речовини?
2. Чи співпадає одержане вами у досліді значення питомої теплоємності речовини з табличним значенням? Якщо ні, то чому?
Додаткове завдання
Користуючись результатами експерименту, оцініть, на який процес витрачається більша кількість теплоти: на нагрівання води чи на нагрівання калориметра?
Це матеріал з підручника Фізика 8 клас Шут
Автор: evg от 12-08-2016, 13:10, Переглядів: 36158