§ 37. Електричний струм у розчинах і розплавах електролітів
Досі ми вивчали закономірності проходження електричного CTpyMj' в металевих провідниках і знаємо, яке велике практичне значення має це явище. А чи існують провідники електрики з неметалів?
Вивчаючи далі явища електричного струму в різних середовищах, переконаємося, що електричний струм, окрім металів, може існувати також у рідинах, газах і навіть у вакуумі. У цих випадках розглядатимемо замкнене коло, у якому є ділянка провідника, що складається з речовини в рідкому чи газуватому стані, або зовсім не містить речовини, тобто є вакуумним проміжком. Провідники, які підводять напругу (струм) до цієї ділянки, називають електродами. Електрод, приєднаний до позитивного полюса джерела струму, називають анодом, а до негативного полюса - катодом. Під час проходження струму до анода притягуються вільні електрони й негативні йони (аніони), а до катода — позитивні йони (катіони).
Ви вже добре знаєте, що для існування електричного струму в речовині, поміщеній в електричному полі, обов’язковою умовою є наявність рухомих, або вільних, електричних зарядів, тобто таких, які можуть в речовині переміщуватися під дією електричного поля на відстані, обмеженій тільки розмірами зразка. У металевих провідниках носіями струму
є вільні електрони, а йони металу жорстко зв’язані у вузлах кристалічних ґраток і можуть здійснювати лише коливальні рухи.
У подібному зв’язаному стані перебувають йони в інших твердих тілах з йонною структурою - йонних кристалах, прикладом яких є звичайна кухонна сіль (NaCl). Вільних електронів у йонних кристалах немає, а ті, що віддають атоми металу (Na*), утворюють негативні йони галогену (СІ ), унаслідок чого виникає хімічний зв’язок. Отже, вільних носіїв електрики в йонних кристалах немає, тому за невисоких температур вони є гарними ізоляторами. У цьому неважко переконатися, якщо спробувати утворити електричне коло, зануривши два провідники, приєднані послідовно з мікроамперметром до джерела струму, у посудину з кристалами сухої кухонної солі: ніякого струму не виявимо.
Якщо ж надати йонам рухливості, перевівши йонні кристали в рідкий стан шляхом їх нагрівання і розплавлення, то речовина стане провідником струму. Відомо, що розплави солей та інших сполук проводять струм. Провідниками струму є також водні та інші розчини солей кислот і лугів.
Дистильована вода, що має молекулярну структуру, є гарним ізолятором, оскільки в ній немає вільних електричних зарядів, отже, у ній не може виникнути електричний струм.
Речовини, водні розчини або розплави яких проводять електричний струм, називають електролітами.
Дослід. Складемо електричне коло, зображене на малюнку 138 (див. с. 104), і наллємо в посудину дистильованої води. Лампа не світитиметься, а амперметр покаже відсутність електричного струму в колі.
Але якщо розчинити у воді яку-небудь сіль, кристали якої мають йон-ну структуру, наприклад кухонну сіль (NaCl) або мідний купорос (CuSO1), то в колі виникне струм, лампа почне світитися. Спробуємо з’ясувати, у чому тут причина.
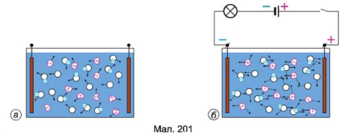
Молекула води полярна, тобто її можна уявляти об’єктом видовженої форми, на кінцях якого зосереджено електричні заряди протилежних знаків. Отже, електричне поле молекул води сприяє розпаду йонних кристалічних ґраток на вільні йони (мал. 201, а).
Руйнуванням кристалічних ґраток супроводжується також процес плавлення солей, у результаті якого утворюється рідина, що складається з вільних йонів.
Розщеплення електроліту на йони у водному розчині або в розплаві називають електролітичною дисоціацією.
Типовими електролітами є солі, кислоти й луги, багато органічних сполук.
Що ж відбудеться, якщо в розчині електроліту створити електричне поле (мал. 201, б)? Очевидно, що позитивні йони (катіони) почнуть рухатися до негативно зарядженого электрода — катода, а негативні йони (аніони) - до позитивно зарядженого електрода (анода). У колі виникне електричний струм, зумовлений напрямленим рухом електричних зарядів обох знаків.
Отже, електричний струм у розчинах електролітів — це впорядкований рух йонів.
Якщо струм проходить крізь розчин мідного купоросу, то із часом виявимо, що на катоді утворився тонкий шар міді. Отже, у розчині під дією електричного поля до катода переміщаються позитивно заряджені йони Cu2+, які під час контакту з катодом приєднують до себе недостатні електрони й нейтралізуються. Нейтральні атоми, що утворилися, осідають на електроді. Бачимо, що на відміну від металів струм в електроліті супроводжується перенесенням речовини.
Процес виділення речовини на електродах під час проходження електричного струму крізь розчини або розплави електролітів називають електролізом.
У 1833-1834 рр. видатний англійський учений Майкл Фарадей експериментально встановив кількісні співвідношення явища електролізу. Перший закон Фарадея для електролізу дає змогу обчислити масу речовини, яка виділяється на електроді.
Маса речовини, яка виділяється на електроді під час електролізу, прямо пропорційна силі струму і часу проходження струму через електроліт:
т = kit,
де т - маса виділеної на електроді речовини; k коефіцієнт пропорційності — електрохімічний еквівалент даної речовини (подається в таблицях); І - сила струму в колі; t - час проходження електричного струму.
Виходячи з першого закону Фарадея, можна експериментально визначити значення електрохімічного еквівалента даної речовини.
Електрохімічний еквівалент визначається відношенням маси речовини, яка виділяється на електроді під час електролізу, до електричного заряду, який пройшов через електроліт:
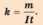
Одиницею електрохімічного еквівалента в CI є один кілограм на кулон (1 кг/Кл).
Електроліз широко застосовується в промисловості. За допомогою електролізу (гальваностегії) можна покривати металеві деталі тонким шаром іншого металу. У такий спосіб проводять нікелювання, хромування, золочення й обміднення різних виробів.
Пропускаючи електричний струм крізь розплави деяких солей, можна виділяти метали в чистому виді. Так отримують алюміній, рафіновану (надчисту) мідь та інші метали. За допомогою електролізу очищають метали від домішок, наприклад неочищену мідь, добуту з руди. Її відливають у формі товстих листів, які потім уміщують у ванну як аноди. Під час електролізу мідь анода розчиняється, домішки, які містять цінні й рідкісні метали, випадають в осад, а на катоді осідає чиста мідь.
У 1836 р. Борис Семенович Якобі (1801-1874) запропонував процес одержання відшаровуваних покриттів (гальванопластику) і застосував його для виготовлення порожнистих фігур, що прикрасили Ісаакіївський собор у Санкт-Петербурзі.
І ЗАПИТАННЯ ДО ВИВЧЕНОГО
1. У чому полягає явище електролітичної дисоціації?
2. Чому кристали з йонним зв’язком є електролітами?
3. Поясніть механізм виникнення струму в електролітах.
4. Назвіть відмінності у проходженні електричного струму в металах та розчинах і розплавах електролітів.
5. Розкажіть, що таке електроліз і де його застосовують.
6. Яка одиниця електрохімічного еквівалента? Що показує значення електрохімічного еквівалента певної речовини?
7. Яке практичне та наукове значення першого закону електролізу Фарадея?
Це матеріал з підручника фізика 8 клас Сиротюк
Автор: evg от 12-08-2016, 10:59, Переглядів: 4574