§ 40. Електричний струм у розчинах і розплавах електролітів. Закон Фарадея для електролізу
Думки вголос
Я знатиму закон, який можна використати для розрахунків задач на електроліз. Зможу пояснювати проходження електричного струму через електроліт.
Електричний струм проходить не лише у твердих тілах, а може бути і в рідинах, якщо вони є електролітами. Водні розчини солей, кислот і основ, а також їх розплави є найкращими електролітами. Носіями струму в них є йони.
Дослід. З’єднаємо послідовно джерело струму, лампу, посудину з дистильованою водою, в яку вставлені вугільні електроди. Лампа не горить (мал. 153, а). Чиста дистильована вода (H2O) практично діелектрик. Кинемо у воду поварену' сіль (NaCl). Лампа почне світитися (мат. 153, б). Водний розчин повареної солі — провідник електрики. Якщо занурити електроди в суху поварену сіль, то лампа не загориться.
Під час розчинення у воді солей, кислот і основ йонний зв’язок у них стає слабкішим, і внаслідок теплових співударах молекули розпадаються на йони. Це явище називають електролітичною дисоціацією. У водному розчині виникають носії електричного струму — йони, заряджені позитивно (катіони), і негативно (аніони). Хімічна реакція розпаду нейтральної молекули NaCl на йони: NaCl <-> Na* + СГ
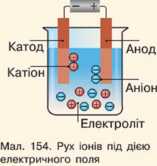
В електричному колі під дією електричного поля позитивні йони рухаються до катода (електрод, заряджений негативно), а негативні йони рухаються до анода (електрод, заряджений позитивно). Через електроліт проходить струм. При цьому разом із зарядом переноситься речовина (мал. 154).

Під час проходження струму через електроліт на електродах відбувається виділення речовини — це явище електролізу. Електроліз супроводжується окислювально-відновними реакціями.
У 1834 р. англійський фізик Майкл Фарадей експериментально відкрив закон електролізу.
Маса виділеної на електроді речовини під час електролізу прямо пропорційна заряду, що пройшов через електроліт. (Закон Фарадея для електролізу): т = к · q, де к — коефіцієнт пропорційності.
Оскільки q = / · ty то т = k · / · t.
Маса виділеної на електроді під час електролізу речовини прямо пропорційна силі струму і часу проходження струму. т — маса речовини, що виділилась на електроді; q — заряд, який пройшов через електроліт; к — електрохімічний еквівалент речовини.
K — коефіцієнт пропорційності в законі, називають електрохімічним еквівалентом.
Коефіцієнт K чисельно дорівнює масі виділеної на електроді речовини під час перенесення йонами заряду, рівного 1 Кл. Різні речовини мають різні електрохімічні еквіваленти, які для розв’язання задач знаходимо з таблиць.
Застосування електролізу
• Гальванотехніка:
а) гальваностегія — покриття деталей тонким шаром металу (позолота, нікелювання, хромування тощо).
б) гальванопластика — відкладання товстого шару металу, який відокремлюється від форми і використовується як виріб (отримання матриць для друкарських пластин, барельєф тощо).
• Електрометалургія — виділення чистих металів із природних сумішей та промислових відходів (міді — із мідного колчедану, алюмінію — із розплавленого бокситу, срібла — із відходів фотовиробництва).
• Очистка металевих деталей (деталь є анодом).
Приклад розв’язування задач. Унаслідок електролізу розчину хлоридної (соляної) кислоти HCl на катоді за деякий час виділилося 75 г водню. Скільки хлору виділилося за цей самий час на аноді? Електрохімічні еквіваленти водню й хлору відповідно дорівнюють 0,0104 мг/Кл і 0,367 мг/Кл.
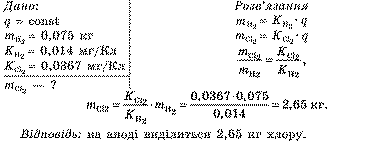
Підсумки
• Водні розчини солей, кислот і основ, а також їх розплави називають електролітами.
• Носіями електричного струму в електролітах є йони обох знаків — позитивно заряджені (катіони) і негативно заряджені (аніони).
• Електроліз — виділення речовини на електродах під час проходження електричного струму через електроліт.
• Закон електролізу (закон Фарадея): маса виділеної на електроді речовини прямо пропорційна заряду, що пройшов через електроліт: т = k-q, де к — електрохімічний еквівалент речовини: т = k- I t
• Електроліз широко застосовують у техніці.
Перевір свої знання
1. Що є вільними носіями зарядів у розчинах електролітів — солей, кислот, лугів?
2. Як змінюється кількість вільних носіїв зарядів в електролітах за зростання температури?
Завдання
1**. Під час електролізу сульфату цинку (ZnSO4) виділилося 2,45 г цинку. Визначити електрохімічний еквівалент цього металу, якщо крізь електроліт протягом 60 хв проходив електричний струм 2 А.
2**. Скільки срібла осіло на катоді електролізної установки, якщо процес електролізу тривав 20 хв, а сила струму складала 25 А? (Срібла= 1>1 мг/·^)
З**. Скільки часу потрібно для нікелювання металевого тіла площею 120 см2, якщо товщина поверхні має становити 0,03 мм? Сила струму дорівнює 0,5 А. (/снікель= 0,3 мг/Кл)
4***. Скільки потрібно витратити електроенергії для отримання чистої міді масою 1 т, якщо напруга на електролітичній ванні за технічними нормами становить 0,5 В? (Ktm = 0,33-10_6 Кг/Кл)
Це матеріал з Підручника Фізика 8 Клас Сердюченко
Автор: evg от 11-08-2016, 15:38, Переглядів: 4004