§ 45. Електричний струм у розчинах і розплавах електролітів.

Тут ти дізнаєшся, що в рідинах, як і в металах, можливий електричний струм, якщо у них розчинені електроліти.
Дослідження показують, що електропровідність речовини суттєво залежить від її агрегатного стану і хімічного складу. Особливо цікаво поводять себе рідини. Для ознайомлення з особливостями електричних процесів, які відбуваються, проведемо декілька дослідів.
1. Візьмемо добре просушену кам’яну сіль, насиплемо її в склянку і введемо в неї вугільні електроди, увімкнуті в електричне коло з джерела, реостата, вимикача і амперметра (мал. 141). Замкнемо коло і побачимо, що жодних змін в положенні стрілки амперметра ми не виявимо.
2. Отже, суха кам’яна сіль не проводить електричний струм. Очевидно, що у ній відсутні вільні носії електричного заряду.
3. Заллємо в склянку дистильовану воду і опустимо в неї електроди з електричним колом попереднього досліду. Результат і цього разу буде негативним: у колі струму не буде. Чиста вода також не проводить електричний струм.
4. Повернемося до першого досліду, виливши воду у склянку з сіллю. Опустивши електроди в суміш, побачимо, що в колі буде проходити електричний струм (мал. 142).
Подібне будемо спостерігати і в дослідах, коли замість кам’яної солі використаємо кислоту чи луг.
Сіль, кислота, луг — це електроліти.
Чисті електроліти мають нейтральні молекули, електричний заряд яких рівний нулю. Будь-яких інших вільних за-
ряджених частинок, носіїв заряду, у них немає. Отже, не виконується головна умова виникнення електричного струму — наявність вільних носіїв заряду.

т = k · q
Електрохімічний еквівалент показує, яка маса речовини відкладається на електроді при електролізі, якщо через розчин пройшов заряд 1 Кл.
т = kiAt
Маса речовини, яка виділяється на електроді при електролізі пропорційна силі струму та інтервалу часу його проходжен н я.
Коли ж електроліти попадають у воду, то електрична взаємодія між частинами молекул зменшуються і нейтральні молекули в процесі теплового руху поділяються на частини, які мають позитивні та негативні заряди. Такі частинки молекул називають йонами. А процес поділу молекул на йони називають електролітичною дисоціацією.
Найпростіший приклад електролітичної дисоціації — розчинення кам’яної солі NaCl, яку ми використовували у дослідах. У процесі розчинення ця молекула розпадається на позитивний йон на-трія і негативний йон хлору:
NaCl -> Na' + СГ.
Якщо після приєднання електродів до джерела струму в розчині з’являється електричне поле, то негативні йони хлору будуть рухатися до позитивного електрода - анода (мал. 143). Тому їх назвали аніонами.
Позитивні ж йони натрія рухатимуться до негативного електрода-катода. Тому ці йони називаються катіонами. Оскільки на електродах йони нейтралізуються і втрачають свої заряди, то утворюються нейтральні молекули, які утворюють чисту речовину. Це можна спостерігати при проходженні струму в водному розчині мідного купороса.
Якщо в розчин мідного купороса у воді опустити вугільні електроди, які увімкнуті в електричне коло (мал. 144), то через деякий час стане помітною зміна кольору одного з електродів. Це — відклалася чиста мідь.
Експериментально встановлено (М. Фарадей), що маса речовини, яка відкладається на електроді при електролізі, пропорціональна заряду, який пройшов через розчин електроліту і залежить від

електрохімічний еквівалент показує, яка маса речовини відкладається на електроді при електролізі, якщо через розчин пройшов заряд 1 Кл.
Оскільки за означенням q-IAt, то формулу закона Фарадея для електролізе можна записати так:
m = Ic-I-At
Маса речовини, яка виділяється на електроді при електролізі пропорціональна силі струму та інтервалу часу його проходження.
Явище електролізу знайшло широке застосування в різних технологічних процесах, а саме: рафінування металів, гальванопластика, гальваностегія.
Таблиця.
Електрохімічні еквіваленти (к. IO3 кг/Кл).
|
Речовина |
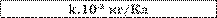 |
|
Алюміній |
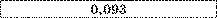 |
|
Золото |
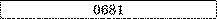 |
|
Мідь |
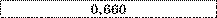 |
|
Нікель |
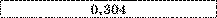 |
|
Срібло |
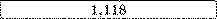 |
|
Хром |
 |
|
Цинк |
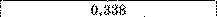 |
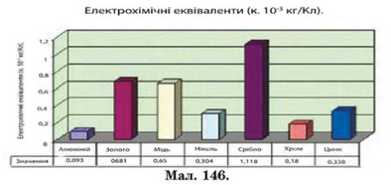
1. Прочитай записи на діаграмі і поясни їх значення.
2. У якої речовини найменше значення електрохімічного еквіваленту?
3. У якої речовини найбільше значення електрохімічного еквіваленту?
4. Яку речовину доцільніше використовувати для захисного покриття з мінімальними затратами електроенергії?
Задача. Якою була сила струму в електролізній вапні з розчином мідного купороса, густина якого весь час підтримувалася сталою, якщо за 2 години на катоді виділилося 23.76 кг міді?

Завдання додому.
Електроліз. За даними таблиці склади задачі, розв’яжи їх і заповни порожні клітинки.
|
Речовина |
 |
 |
 |
|
Алюміній |
 |
 |
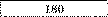 |
|
Золото |
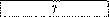 |
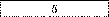 |
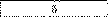 |
|
? |
 |
 |
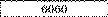 |
|
Нікель |
 |
 |
 |
|
Срібло |
 |
 |
 |
|
Хром |
 |
 |
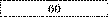 |
|
Цинк |
 |
 |
 |
Прочитай і з*ясуй, що ти знаєш,
1. Які речовини відносяться до електролітів?
2. Як відбувається електролітична дисоціація?
3. Яка природа струму в розчинах електролітів?
4. Які частинки називаються аніонами?
5. Які частинки називаються катіонами?
6. Від чого залежить маса речовини, що виділяється на електроді при електролізі?
7. Як формулюється закон Фарадея для електролізу?
8. Чи зміниться сила струму в електроліті, якщо його підігріти?
Добування алюмінію.
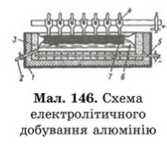
Одним із прикладів застосування електролізу е добування алюмінія. У промисловості алюміній добувають електролізом розчину оксиду алюмінію в розплавленому кріоліті Na3AlF6 з добавкою фториду кальцію CaF2. Електроліз здійснюють при температурі 950—980 ‘C. Сировину використовують чисту, оскільки домішки при електролізі відновлюються і забруднюють алюміній.
Процес відбувається в електролізері (мал. 146), який являє собою сталеву ванну прямокутної форми 1, викладену зсередини вогнетривкою цеглою і блоками з вугільної маси 3. У блоки на дні ванни закладено сталеві стрижні, кінці яких виведено назовні. Ці блоки разом з розплавленим алюмінієм є катодом. Анод 4 складається з 12—14 вугільних брусків і зверху опущений у ванну. При завантаженні ванни спочатку вводять кріоліт і фторид кальцію. Після їх розплавляння (пропусканням електричного струму) додають чистий оксид алюмінію або очищений боксит. Кисень, що виділяється, окиснює вугільний анод до CO і CO,. Матеріал анода при цьому витрачається, тому анод в міру окиснення поступово опускається.
Згори і біля бічних стінок ванни електроліт охолоджується навколишнім повітрям і застигає суцільною кіркою 7. У ній біля анодів пробивають отвори для виходу газів, які утворюються під час окиснення анода. Рідкий алюміній випускається з ванни через канал 2.
Виробництво алюмінію потребує значних витрат електроенергії і матеріалів: для добування 1 т алюмінію витрачається близько 20 тис. кВт год електроенергії, близько 2 т оксиду алюмінію, 40—60 кг кріоліту, 20—30 кг добавок інших фторидів і 20—30 кг анодного вугілля. Тому заводи з виробництва алюмінію звичайно будують біля великих гідроелектростанцій, які виробляють дешеву електроенергію. Зокрема, один з таких заводів працює у Запоріжжі, де ДніпроГЕС дає дешеву електроенергію у великій кількості.
Це матеріал з Підручника Фізика 8 Клас Савченко
Автор: evg от 11-08-2016, 14:56, Переглядів: 1807