§ З0. Природа електричного струму в розчинах і розплавах електролітів. Закони Фарадея для електролізу
ДОСЛІД 30.1. Отримання міді з розчину мідного купоросу
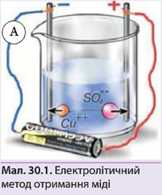
1. Розчинимо сині кристали мідного купоросу (CuSOi1-SH2O) у воді. Вода також зафарбується у синій колір.
Cu - хімічний знак міді, S - сірки,
O - кисню. У розчині мідний купорос розпадається на іони Cu+* і S“ Подвійні значки «++» чи «—» означають, що ці іони двозарядні, тобто мають по два надлишкові елементарні заряди, їх валентність z = 2.
2. Приєднаємо батарейку до двох графітових електродів (без лампочки) і будемо спостерігати (мал. ЗОЛ). Графітові електроди можна виготувати, вийнявши грифель із простого олівця. Біля анода, як і в попередньому досліді, будуть збиратися бульбашки газу.Найцікавіші для нас події відбуватимуться біля катода: через кілька хвилин він почне червоніти, і чим далі, тим більше. Це осідають на катод йони міді Cu+*. Чим довше ми будемо пропускати струм, тим більше їх підійде до катода. Йони міді отримають від катода два електрони, яких їм не вистачає, щоб перетворитися на нейтральний атом міді (у цьому розчині іон міді двозарядний), і осядуть на електроді у вигляді металічної міді. Такий метод отримання міді, як показано в досліді 30.1, називається електролітичним.
Спосіб отримання дуже чистої міді електролітичним способом для провідників називають рафінуванням (очищенням). Таку мідь називають електротехнічною і використовують, наприклад, для виготовлення мідного дроту. Алюміній отримують тільки за допомогою електролізу.
Розкладання електроліту на складові при пропусканні через нього електричного струму називають електролізом.
Перший закон електролізу
Якщо зважити катод до і після проведення електролізу, то можна визначити масу міді, що виділилася. Англійський фізик Майкл Фарадей дослідним шляхом
встановив, що маса речовини, яка виділяється на електродах прямо пропорційна заряду, який пройшов через розчин:
т = k-q, (30.1)
це перший закон Фарадея для електролізу. Коефіцієнт «/с» називають електрохімічним еквівалентом і він залежить від виду речовини, що виділяється.
Від маси виділеної речовини та заряду, що пройшов через розчин, електрохімічний еквівалент не залежить.
Заряд, який пройшов через розчин, можна виразити через час проведення електролізу «/» і струм «/»: q = It. Тепер формулу (30.1) можна записати по-іншому:
т = kit. (30.2)
В такому вигляді формула містить величини, які легко виміряти і придатна для практичного застосування. З неї, наприклад, можна обчислити електрохімічний еквівалент, який необхідно знати, щоб в подальшому визначати масу речовини, що виділяється.
ДОСЛІД 30.2
В досліді, зображеному на малюнку ЗОЛ, маючи терези, амперметр і секундомір, можна практично визначити електрохімічний еквівалент міді за формулою:

Під час проведення досліду потрібно слідкувати, щоб струм не змінювався за величиною. Масу катоду потрібно визначити з максимально можливою точністю. Після проведення електролізу міді, катод необхідно спочатку висушити в теплому місці (щоб не зважити воду, яка змочила електрод).
Електрохімічний еквівалент міді досить мале число і його вимірюють у мг/Кл. (табл. ЗО. 1).Фізичний зміст коефіцієнту наступний - він чисельно дорівнює масі речовини, що виділилась в результаті проходження через розчин електроліту заряду 1 Кл.
Таблиця 30.1
Електрохімічні еквіваленти, ыг/Кл
|
Речовина |
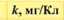 |
Речовина |
 |
|
Алюміній (АГ**) |
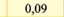 |
Хром (Crm) |
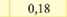 |
|
Мідь (CiCf) |
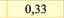 |
Золото (Aum) |
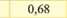 |
|
Цинк (ZrCf) |
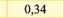 |
Срібло (Ag+) |
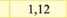 |
|
Нікель (Ni+1) |
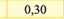 |
Водень(Н) |
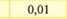 |
► ПРИКЛАД ЗОЛ
Скільки часу (в хвилинах) відбувалося нікелювання, якщо при силі струму 2 А на виробі осіло 0,9 г нікелю?
Розв'язання:

Відповідь: для нікелювання виробу потрібно 50 хв.
ПРИКЛАД 30.2
Потрібно покрити поверхню сталевої ложки площею S = 22,4 см2 шаром срібла товщиною d = 60 мкм. Який струм треба пропускати через розчин електроліту, щоб процес тривав 10 хв? Густина срібла р = 10,5 г/см3. Розв'язання:
Необхідно скористатися формулою (30.2): т = k i t. Масу потрібного шару срібла можна визначити за формулою: т = p-V, де V= Sd. В результаті отримуємо формулу:
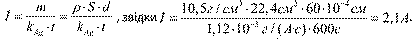
Відповідь: потрібен струм 2,1 А.
Другий закон електролізу
При проходженні через розчин електроліту кожен одновалентний (однозарядний) йон {z = 1) переносить один елементарний заряд «е?» і масу, що дорівнює масі йона. Якщо йон двовалентний (z = 2), то при тому самому заряді, що пройшов через розчин, необхідна вдвоє менша кількість йонів, отже, на електроді осяде вдвоє менша маса речовини. Наведемо аналогію: для того, щоб переправити через річку певну кількість людей, потрібно вдвоє менше двомісних човнів, ніж одномісних.
Масу речовини, що виділяється на електроді, можна обчислити за формулою:
т = HIq-Ni (30.4)
де N - кількість йонів, a mQ - маса йона. Заряд, що пройшов через розчин, дорівнює:
де z-e - заряд йона, z - валентність. Підставимо масу і заряд з виразів (30.4) та (30.5) у формулу (30.1) і отримаємо: wft-iV = к (z-e)-N. Скоротимо на N і пригадаємо, що W0= MZNa (вираз 1.1). Отримуємо вираз MZNa = к (z-e), звідки:


Фізичний зміст виразу (30.6) наступний: електрохімічний еквівалент прямо пропорційний хімічному еквіваленту - це і є другий закон електролізу. Виходить, що електрохімічний еквівалент залежить тільки від молярної маси речовини та валентності йонів. Формула (30.6) дозволяє, провівши дослід з електролізу, обчислити важливу сталу - число Авогадро.
Застосування електоолізу
1. Рафінування міді. Слово «рафінування» означає «очищення». Мідні руди містять різноманітні сполуки міді, окиси міді і сторонні метали. Відливки міді у вигляді пластин поміщаються в розчин мідного купоросу CuS04 в якості аноду. При невеликій напрузі порядку 1 В, на катоді виділяється тільки чиста (так звана електролітична) мідь, яка використовується в електротехнічній промисловості, зокрема для виробництва мідного дроту. Рафінування проводять у ємностях, які називають електролітичними ваннами. Електроди, які при цьому використовуються, повинні мати велику площу поверхні.
2. Електрометалургія. Отримання алюмінію. Алюміній отримують при пропусканні струму через розплави бокситів, які містять окис алюмінію АІ203. Оскільки вживані струми досить великі, то виділяється велика кількість тепла, підтримуючи розплав в рідкому стані протягом всього процесу.
3. Гальваностегія - покриття поверхні одних металів тонким шаром інших металів. Наприклад, з метою уникнення корозії чи придания гарного вигляду, поверхню стальних деталей покривають шаром хрому, нікелю, срібла чи золота. Так поверхні «золотих» годинників покриті шаром золота товщиною усього 35-50 мкм. Блискучий домашній посуд, в основному, покрито шаром нікелю, ложки, виделки - сріблом, золотом. Дзеркальні поверхні деталей мотоциклів та автомобілів покривають шаром хрому.
4. Гальванопластика. Гальванічним способом на плоских металічних плас-
тинах можна отримати рельєфні поверхні. Так виготовляють матриці для карбування монет, медалей та вінілових дисків, які знову в моді у любителів музики.
5. Фотолітографія - використовується при виготовленні пластин для друку в поліграфічній та електронній промисловості. При виготовленні мікросхем поверхню сіліконової пластини спочатку полірують за допомогою електролітичного процесу (який називають електрополіруванням), вирівнюючи невеликі виступи розміром в соті частини мікрона. Потім вибудовують на невеличкій поверхні десятки мільйонів транзисторних схем, використовуючи світло і електроліз. Установки, які це роблять називають епітаксіальними, з їх допомогою виготовляють мікропроцесори і елементи пам'яті для комп'ютерів, планшетів, мобільних телефонів та іншої цифрової техніки.

ІСТОРИЧНА ДОВІДКА
Майкл Фарадей народився в сім'ї лондонського коваля. Батьки зуміли дати йому тільки початкову освіту і з 13 років він уже працював палітурником в книжковому магазині. Переплітаючи Британську енциклопедію, він прочитав усі статті з фізики та хімії і проробив описані там досліди. Фарадей став одним з найвидатніших англійських вчених, зокрема відкрив закони електролізу. За одинадцять років він подолав шлях від лаборанта хімічної лабораторії до академіка. Фарадей відмовився від поста Президента Королівського товариства (Англійської академії наук) і від дворянського титулу.
КОРОТКІ ПІДСУМКИ
Розкладання електроліту на складові при пропусканні через нього електричного струму називають електролізом. Маса речовини, яка виділяється на електродах прямо пропорційна заряду, який пройшов через розчин: т = к q - перший закон електролізу.
Електрохімічний еквівалент прямо пропорційний хімічному еквіваленту:
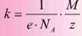
другий закон електролізу.
* Число Фарадея F = e-N^ яке можна визначити дослідним шляхом, дозволяє обчислити сталу Авогадро Л'д.
ВПРАВА №30_
1. Назвіть декілька відмінностей між проходженням струму а) через тверді й рідкі метали, б) через рідкі метали і електроліти.
2. Чим відрізняються йони міді і натрію?
3. Чого більше, електронів чи протонів у а) позитивному, б) негативному йоні?
4. Чому мідь при електролізі осідає саме на катоді?
5. Чим відрізняється проходження струму через ртуть і через мідний провідник?
6. Яка причина того, що йони рухаються саме до «своїх» електродів?
7. Дві однакові банки (як на мал. ЗО. 1) містять розчин мідного купоросу різної концентрації. Де виділиться більше міді, якщо банки з'єднані а)послідовно, б)* паралельно?
8. Яка маса міді (в грамах) виділиться на катоді при пропусканні через розчин мідного купоросу струму З А на протязі ЗО хвилин?
9. Поверхню стального чайника площею 200 см2 потрібно покрити шаром хрому товщиною 50 мкм, при струмі 2 А. Скільки часу триватиме процес електролізу? Густина хрому 7,2 г/см3.
10. У досліді з визначення електрохімічного еквіваленту міді струм становив 1 А на протязі 8 хвилин. Маса катоду до досліду дорівнювала 22,35 г, а після досліду 22,52 г. Яке значення електрохімічного еквіваленту міді отримали?
11. До анода і катода доторкнулись одночасно два іони: Си++ і. Який заряд (в елементарних зарядах) пройшов через провідник, що з'єднує електроди?
12. Порівняйте маси алюмінію і срібла, виділені на катодах при послідовному з'єднанні електролітичних ванн.
13. Яку кількість електроенергії (в кВт-год) потрібно затратити на рафінування 1 т міді? Процес рафінування відбувається в електролітичній ванні при напрузі 0,5 В. Порівняйте отриманий результат з кількістю електроенергії, яку споживає ваша сім'я за місяць.
14. Наведіть приклади застосування електролітичних технологій.
15. Користуючись таблицею Менделєєва, обчисліть електрохімічний еквівалент (у мг/Кл) двовалентного олова Sn. (0,6 мг/Кл).
16. Який електрохімічний еквівалент одновалентної міді?
17. Яким буде числове значення (в мг/Кл) електрохімічного еквіваленту срібла у випадку, коли його йони Ад++ двовалентні?
Цей матеріал з підручника Фізика 8 клас Пшенічка
Автор: evg от 11-08-2016, 14:29, Переглядів: 2936