§ 23. Джерела електричного струму. Гальванічні елементи й акумулятори
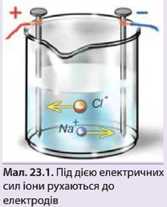
Тепер вияснимо, чому електроліти проводять струм. Ми вже говорили, що при розчиненні у воді сіль розпадається на окремі позитивно заряджені іони натрію Na+ і негативно заряджені іони хлору СІ". Ці іони рухаються під дією електричних сил до електродів протилежного знаку, Na+ - до катода, a Cl— до анода (мол. 23.1). Підійшовши до анода, іони хлору віддають зайвий електрон і перетворюються на нейтральні атоми, які об'єднуються в молекули Cl2 і виділяються у вигляді бульбашок газу.Кожного разу, коли іони отримують (або віддають) електрони, у провідниках і лампочці проходить струм, який відновлює надлишок зарядів на електродах. За цим «слідкує» батарейка. «Пригоди» натрію складніші, він втягує у свої хімічні ігри ще й водень, але про це іншим разом.
ДОСЛІД 24.1. Визначення полюсів батарейки
Розріжте сиру картоплину. На певний час доторкніться до поверхні зрізу провідниками від полюсів батарейки. Що ви побачили? Зробіть висновки.
Пропускання струму через електроліти спричиняє в об'ємі розчину і біля електродів хімічні реакції. Але можливий і зворотний ефект: можна отримати струм за рахунок хімічних реакцій між двома різними провідниками і електролітом.
Хімічне джерело струму
Утворення струму в електролітах вперше (цілком випадково) відкрив італійський фізіолог Луїджі Гальвані, на честь якого хімічні джерела струму називають гальванічними. Перший діючий гальванічний елемент вдалося створити італійському фізику Алессандро Вольта. Він занурив мідний та цинковий електроди у розчин сірчаної кислоти H2SO1. Коли він з'єднав пластини електродів провідником, пішов струм (мал. 23.2).
Причина виникнення струму полягає в наступному: в результаті хімічних реакцій сірчаної кислоти з електродами цинкова пластина заряджається негативним зарядом, а мідна - позитивним.
Що відбувається всередині елемента Вольта
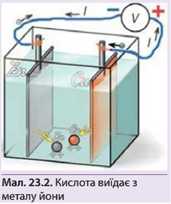
Розглянемо роботу елемента Вольта -хімічного джерела струму, що складається з цинкової і мідної пластин, занурених у розчин сірчаної кислоти.
Кислота починає розчиняти електроди. При цьому вона «виїдає» з металу не атоми, а йони, тобто атом цинку покидає електрод у вигляді позитивного йона Zn++, залишивши свої два електрони пластині (мал. 23.2). Те саме відбувається і з атомами міді. Таким чином, обидві пластини в результаті хімічної реакції заряджаються негативно. Але цинк розчиняється значно швидше, і цинкова пластина накопичує більше електронів, тобто вона набуває більшого негативного заряду, ніж мідна.
Якщо з'єднати пластини провідником, то електрони в ньому побіжать від цинкового електрода до мідного, а струм, згідно з правилом, - піде від міді до цинку. Тому на мідному електроді необхідно поставити знак «+», а на цинковому знак «-». Зверніть увагу: корпус пальчикових батарейок, які ви використовуєте, завжди цинковий і завжди негативний. Якщо вам потрібен цинк для дослідів, то його можна добути зі старих батарейок.
Електрорушійна сила джерела струму (EPC)
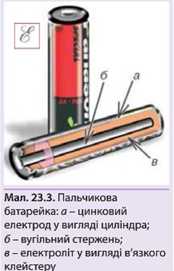
Сучасні хімічні джерела струму (мал.
23.3) - це далекі «нащадки» елемента Вольта, їх завдання полягає в тому, щоб виробляти енергію, яка використовується для живлення різноманітних портативних приладів, якими ми користуємось. Значення енергії, яку джерело струму виробляє в розрахунку на Ί Кл заряду, називається електрорушійною силою (скорочено ЕРС). Цю фізичну величину позначають літерою E і вимірюють у вольтах.

де /Iciop - робота сторонніх сил - в гальванічному елементі це сили хімічного походження. Згідно з (23.1) робота сторонніх сил дорівнює:

Величина EPC зазначена, наприклад, на корпусі пальчикової батарейки. Для вимірювання & треба приєднати вольтметр безпосередньо до джерела струму. Причому виміряне значення не обов'язково точно збігається з тим, що написане на корпусі, оскільки елементи відрізняються один від одного, навіть якщо вони випущені в одній серп.
КОРИСНО ЗНАТИ *
• Однакові за внутрішньою будовою та зовнішнім виглядом батарейки часто відрізняються за ціною в декілька разів. Причина криється в ступені чистоти матеріалів, з яких вони зроблені. Два електроди, виготовлені, наприклад із цинку і вугілля, можуть відрізнятися вмістом різної кількості домішок інших хімічних речовин. Якщо домішок багато, то кожний електрод сам містить якусь кількість невеликих джерел, які породжують так звані «паразитні» струми, навіть якщо елемент не використовується. Термін зберігання такого елемента невеликий, оскільки він швидко спрацьовується, і
Акумулятор

Якщо занурити в розчин сірчаної кислоти два однакові електроди (наприклад, свинцеві), то струму не буде. Але якщо пропустити через розчин струм від зовнішнього джерела, то почнуться хімічні зміни поверхні свинцевих електродів. Поверхня одного з них покриється сірчанокислим свинцем (PbSO4, Pb - plumbum - свинець), а іншого - окислиться, утворивши сполуку PbO2). Так відбувається «заряджання» акумулятора, в результаті чого електроди стають різними. Після заряджання акумулятор стає гальванічним елементом, який працює до того часу, поки свинцеві пластини не відновляться до початкового (чистого) стану. Потім акумулятор треба знову зарядити. Хімічні процеси в акумуляторі проходять тільки на поверхні пластин і є зворотними. Чим більша площа пластин, тим більший електричний заряд накопичує акумулятор.
Свинцеві кислотні акумулятори використовують у сучасних автомобілях (мал.
23.4). Побудовані вони дещо складніше, ніж
ми описали вище, але суть процесів, що в них відбуваються, та сама. Широко застосовуються залізо-нікелеві акумулятори з лужним електролітом.
Часто замість батарейок використовуються акумулятори, які зовнішнім виглядом від них не відрізняються. Проте відпрацьовані батарейки викидають, а акумулятор можна використовувати багаторазово, заряджаючи його час від часу за допомогою зарядного пристрою. Коштують акумулятори і зарядний пристрій дорожче, ніж батарейки, але загалом, за рахунок багаторазового використання, обходяться дешевше.
Кількість заряду, який може накопичити акумулятор чи виробити гальванічне джерело струму, вимірюють в ампер-годинах. Одна ампер-година в кулонах дорівнює:
q = /♦/ = IA l год. = 1 А-3600 с = 3 600 Кл.
Отже, Ί ампер-година - це 3 600 кулонів електричного заряду.
ДОСЛІД 23.2. Вивчення гальванічних елементів
Ί. Для проведення досліду потрібні три пальчикові елементи струму, з'єднувальні проводи і мультиметр.
2. Перемкніть мультиметр у режим вольтметра (на позначку 20) і приєднайте щупи до полюсів одного елемента. Виміряну напругу позначте U1 (мал. 23.5). Потім виміряйте напруги двох інших елементів: U2 і Ur Напруги можуть виявитися як однаковими, так і різними.
3. З'єднайте два елементи послідовно (+ -, + -) в батарею (таке з'єднання називають узгодженим). Виміряйте напругу U4на батареї, приєднавши щупи мультиметра до негативного полюса першого елемента і позитивного полюса другого (мал. 23.6). Елементи повинні бути добре притиснуті один до одного.
4. З'єднайте послідовно три елементи (+ + -). Виміряйте напругу
U.на батареї, приєднавши щупи мультиметра до негативного полюса першого елемента і позитивного полюса третього.
5. З'єднайте три елементи послідовно (+ -, + -,-+)- таке з'єднання називають неузгодженим. Виміряйте напругу U6на батареї, приєднавши
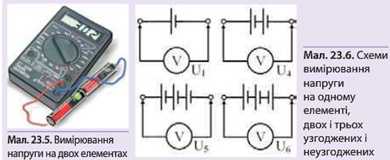
щупи мультиметра до негативного полюса першого елемента і позитивного полюса третього. Запишіть дані досліду в таблицю.
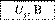 |
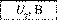 |
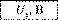 |
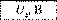 |
 |
 |
6. Яку закономірність ви помітили при вимірюванні напруги на батареях у кожному випадку? Зробіть висновки.
КОРОТКІ ПІДСУМКИ
В елементі Вольта в результаті хімічних реакцій сірчаної кислоти з електродами цинкова пластина заряджається негативним зарядом, а мідна -позитивним.
Робота сторонніх сил, наприклад хімічних у гальванічних елементах, виробляється енергія, за рахунок якої живиться електричне коло:
Апор = £'4-
Для вимірювання EPC елемента потрібно приєднати вольтметр безпосередньо до джерела струму.
ВПРАВА №23
1. Чи можуть давати струм два електроди, які виготовлені з різних металів, якщо їх занурити в розчин лугу?
2. Чому мідний і цинковий електроди заряджаються, якщо їх опустити в розчин кислоти?
3. Чому мідний електрод заряджений позитивно відносно цинкового, коли вони знаходяться в розчині кислоти?
4. Що відбувається в акумуляторі під час заряджання?
5. Чому незаряджений акумулятор не дає струму?
6. Чому від зарядженого акумулятора можна отримати струм?
7. Ємність акумулятора 5 ампер-годин. Який заряд можна накопичити в акумуляторі?
8. Ємність батарейки 2 ампер-години. Який заряд вона може виробити за весь час своєї роботи?
9. Чому між однаковими електродами, зануреними в електроліт, не проходить струм, якщо їх з'єднати провідником?
10. Чи можна отримати гальванічний елемент, зануривши мідну і цинкову пластини у розчин цукру?
ІСТОРИЧНА ДОВІДКА Гальвані і Вольта
В 1780-ті роки професор фізіологи з університету Болоньї (Італія) Луїджі Гальвані проводив модні на той час досліди з препарованими жаб'ячими
лапками. Через нерв лапки був продітии міднии гачок. Торкаючись до гачка провідником, що йшов від електричної машини, крізь лапки пропускали електричний розряд. Лапки при цьому здригались, і було незрозуміло, чому так відбувається. Розповідають, що одного разу, вийшовши на балкон, дружина вченого помітила здригання лапок, які були просто підвішені на мідних гачках до залізного дроту. Поряд звисав обрізок залізного дроту, який час від часу доторкався до лапок, саме в цей момент вони здригалися.

Досліджуючи це явище, Гальвані помітив, що лапки здригаються, коли до них торкаються два будь-які (але різні) метали. Гальвані вважав, що причиною електричного ефекту є самі лапки, тобто організм сам виробляє електрику, як це буває в електричного ската чи вугра.
Шукаючи справжню причину цього явища, інший італійський учений, який працював неподалік, в університеті міста Падуя, граф Алессандро Вольта, зумів переконливо довести, що лапки тут ні при чому. Він з'ясував, що коли два електроди з різних металів опустити в розчин солі або кислоти (електроліт), то вони можуть давати струм. Жаб'ячі лапки в даному випадку були просто чутливим приладом, який реагував на струм скороченням м'язів, а м'язова тканина - електролітом. Справа в тому, що у живих істот м'язи скорочуються під дією сигналів, які надходять із мозку у вигляді електричних імпульсів.
У своїх перших гальванічних елементах Вольта використовував для електродів цинк (Zn - zinc) і срібло (Ag - argentum). Вольта перепробував багато пар металічних електродів і встановив, що вугіль також підходить. Потім він додумався з'єднати електроди послідовно: цинк - електроліт - срібло -цинк - електроліт - срібло і т. д. - так званий Вольтів стовп (мал. 23.7) Це було геніальним винаходом, тому що напруга, яка створювалася однією парою електродів (близько 1 В), багатократно підсилювалась. Вольта опублікував свої дослідження у 1800 році.

На відміну від електростатичних машин, які давали досить велику напругу, але впродовж дуже малих інтервалів часу, елемент Вольта працював довго. З появою цього джерела постійного струму з'явилося багато нових можливостей для вивчення електрики. Наприклад, можна було дослідити, як впливає на речовину тривале проходження струму через неї.
Президент Французької академії наук Драго писав, що прилад Вольта «був найчудовішим приладом, який коли-небудь винайшла людина, не виключаючи телескопа і парової машини». Винахід Вольтового стовпа (1800 р.) справив дуже велике враження на весь учений світ. У тому самому році було встановлено теплову дію струму, який розігрівав провідник і міг його навіть розплавити, а також відкрито явище електролізу.
Вольта запросили в найбільші на той час наукові академії Франції та Англії показувати свої досліди. Він був нагороджений премією «Благодійникам людства» за видатні досягнення в галузі електрики. Сам імператор Наполеон був присутній при демонстрації дослідів у Паризькій академії.
Цей матеріал з підручника Фізика 8 клас Пшенічка
Автор: evg от 11-08-2016, 14:22, Переглядів: 3431